��Ŀ����
����Ŀ��2016���й���ѧ�ҳɹ��ϳ�NiO/TiO2���ˮ����������Ч�ĸ��ѿ�̫���ܵ�أ�Ϊ�����ԴΣ�����������������ش��ס���ش��������⣺
(1)TiO2�뽹̿��Cl2�ڸ����·�Ӧ�Ļ�ѧ����ʽΪ��TiO2+2C+2Cl2 ![]() TiCl4+2CO��
TiCl4+2CO��
�ٻ�̬��ԭ�ӵļ۵����Ų�ʽΪ_________________��
�ڸ÷�Ӧ���漰���ķǽ���Ԫ�صĵ縺�Դ�С˳��Ϊ_______________________��
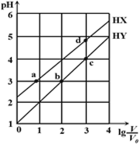
(2)��֪NiO/TiO2������������ɻ������ҵĹ�����ͼ��ʾ��

������ķе�С�ڻ������ҵķе㣬��Ҫԭ����___________________���ڻ��������У���ԭ�ӵ��ӻ���ʽ��______________��
(3)CH3NH3+��Ti4+��Pb2+��Cl-����������������ѿ�̫���ܵ�ص���Ҫ���ӡ�CH3NH3+������H��N��H���ļ��DZ�NH3������H��N��H���ļ��� ______ �����С������ԭ����_____________ ��
(4)Sb(��)��Ga(��)��±�����кܶ���;��һ�������½�SbCl3��GaCl3�����ʵ���֮��Ϊl��l��Ӧ�õ�һ�ֹ�̬���ӻ��������������������ֽṹ������Ϊ���й��ڽṹ��˵���к������� ____ ��
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. û��������ϣ����ж�
(5)�����Ѿ���(��ͼ1��ʾ)�������ɸ����������϶��ͼ1��a��b��c��d�ĸ���ԭ���γɵ������������ڲ���϶�п����������ԭ�ӡ�
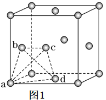
����ش𣬽����Ѿ����Ľṹ����____________��
a. ������ b. �������� c. �������� d. ���ʯ��
�������������е����������϶�ж������ԭ�ӣ���ô�γɵ��⻯�ѵĻ�ѧʽΪ______________��
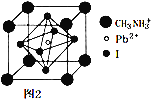
(6)ij���ѿ�̫���ܵ�ز��ϵľ�����ͼ2��ʾ���侧������Ϊd pm���ܶ�Ϊ�� g��cm-3����þ����Ħ������________ g��mol-1�����ú�d�����ȷ��ŵ�ʽ�ӱ�ʾ����NA��ʾ�����ӵ�������ֵ��
���𰸡�3d24s2 O��Cl��C ���߾�Ϊ���Ӿ��壬�����������γɷ��Ӽ���� sp3 �� �ɼ�����(C-N��)��H-N�����ų���С�ڹµ��ӶԶ�H-N�����ų��� a c TiH2 d3��NA��10-30
��������
(1)��Ti��22��Ԫ�أ���������Ų�ʽ��1s22s22p63s23p63d24s2����۲�����Ų�ʽ��3d24s2��
���ڷ�ӦTiO2+2C+2Cl2 ![]() TiCl4+2CO���漰�ķǽ���Ԫ����C��O��Cl��Ԫ�صķǽ�����O��Cl��C��Ԫ�صķǽ�����Խǿ������Ӧ�ĵ縺��ҲԽ������Ԫ�صĵ縺���ɴ�С��˳��ΪO��Cl��C��
TiCl4+2CO���漰�ķǽ���Ԫ����C��O��Cl��Ԫ�صķǽ�����O��Cl��C��Ԫ�صķǽ�����Խǿ������Ӧ�ĵ縺��ҲԽ������Ԫ�صĵ縺���ɴ�С��˳��ΪO��Cl��C��
(2)������ס��Ҷ����ɷ��ӹ��ɵķ��Ӿ��壬����֮��ͨ�����Ӽ���������ϣ������������л����а���������Nԭ�Ӱ뾶С��Ԫ�طǽ�����ǿ������֮�仹��������������˷���֮�����������ʹ���ҵ��۷е�ȼߣ��ڻ���������Oԭ�Ӽ۲���Ӷ�����4�����Oԭ���ӻ�����Ϊsp3�ӻ���
(3)���ڹ¶Ե�����ɼ����ӶԼ���ų����ô��ڳɼ����Ӷ�֮���ų����ã����Զ���CH3NH3+�����У��ɼ�����(C-N��)��H-N�����ų���С�ڹµ��ӶԶ�H-N�����ų���������H��N��H���ļ��DZ�NH3������H��N��H���ļ��Ǵ�
(4)SbCl3��Sbԭ����Χ�۲���Ӷ���Ϊ4����GaCl3������Gaԭ����Χ�۲���Ӷ���Ϊ3���ǵ��ӶԵĽ����壬��������Cl-�ϵŵ��ӶԽ�ϣ��γ���λ��������[GaCl4-]���ӣ���˿��ܽṹӦ��[SbCl2+][GaCl4-]���ʺ���ѡ����a��
(5)�ٸ��ݾ���Ti�Ľṹ��֪��Tiԭ���ھ����Ķ���������ϣ����Ti���������������ܶѻ����ʺ���ѡ����c��
����Ti�����к���Tiԭ����ĿΪ8��![]() +6��
+6��![]() =4����a��b��c��d�ĸ���ԭ���γɵ������������ڲ���϶�п����������ԭ�ӣ�����ͼʾ��֪1��Ti���������γ�8���������壬������8��Hԭ�ӣ����Ըþ�����Ti��Hԭ�Ӹ�����Ϊ4��8=1��2���ʻ�����Ļ�ѧʽΪTiH2��
=4����a��b��c��d�ĸ���ԭ���γɵ������������ڲ���϶�п����������ԭ�ӣ�����ͼʾ��֪1��Ti���������γ�8���������壬������8��Hԭ�ӣ����Ըþ�����Ti��Hԭ�Ӹ�����Ϊ4��8=1��2���ʻ�����Ļ�ѧʽΪTiH2��
(6)��������Ϊd pm=d��10-10 cm���ܶ�Ϊ�� g��cm-3�������![]() ��֪�þ���ľ�������Ϊm=(d��10-10cm)3���� g��cm-3=d3����10-30 g��1 mol�����к��о�����ĿΪNA�����Ըþ����Ħ������M=mNA=d3����10-30 g��NA/mol=d3��NA��10-30 g/mol��
��֪�þ���ľ�������Ϊm=(d��10-10cm)3���� g��cm-3=d3����10-30 g��1 mol�����к��о�����ĿΪNA�����Ըþ����Ħ������M=mNA=d3����10-30 g��NA/mol=d3��NA��10-30 g/mol��

����Ŀ��������ʵ������һ���ܵó���Ӧ���۵���
ѡ�� | A | B | C | D |
װ�û���� | ȡ��֧�Թܸ�����4 mL 0.01 mol/L�IJ�����Һ���ֱ�μ�2 mL 0.1 mol/L��0.2 mol/L�ĸ��������Һ |
|
| ��ֱ�ʢ��5 mL 0.1 mol/L�������������Һ���Թ��еμ�5 mL 0.1 mo/L��������Һ��һ��ʱ��ֱ������ˮ����ˮ�С� |
���� | ��ɫ���۲���ɫ��ʱ�� | ��������ƣ��ұ�������� | �Թ����ȳ��ֵ���ɫ���壬����ֻ�ɫ���� | �Թ���Һ����������ˮ�����ȳ��ֻ��� |
���� | ������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� | �����ԣ�Cl2>Br2>I2 | �ܽ�ȣ�AgCl>AgBr>AgI | ����˵���¶�Խ�ߣ�����Խ�� |
A.AB.BC.CD.D
����Ŀ��700��ʱ��H2(g)��CO2(g)![]() H2O(g)��CO(g)�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v(H2O)Ϊ0.025 mol/(L��min)�������жϲ���ȷ����()
H2O(g)��CO(g)�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v(H2O)Ϊ0.025 mol/(L��min)�������жϲ���ȷ����()
��ʼŨ�� | �� | �� | �� |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. ƽ��ʱ������CO2��ת���ʴ���50��
B. ����Ӧƽ��ʱ������c(CO2)�Ǽ��е�2��
C. �¶�����800�棬������Ӧƽ�ⳣ��Ϊ25/16��������ӦΪ���ȷ�Ӧ
D. �����������䣬����ʼʱ���������г���0.10mol/L H2��0.20 mol/L CO2������ƽ��ʱc (CO)���Ҳ�ͬ