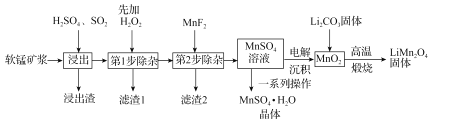
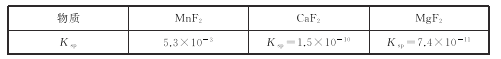
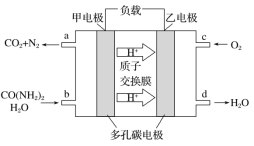
题目内容
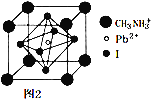
【题目】芳香族化台物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉非酸,再与甲醇酯化制得。下列说法不正确的是

A. 肉桂酸甲酯的分子式为C10H10O2
B. 电解肉桂醇制得的肉桂醛在电解池的阴极生成
C. 1mol肉桂酸甲酯与H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面内
【答案】B
【解析】根据球棍模型,结合原子成键规律可知,肉桂酸甲酯结构简式为![]() ,分子式为C10H10O2,A正确;由肉桂醇变为肉桂醛的过程属于氧化反应,应该在电解池的阳极生成,B错误;根据结构简式可知
,分子式为C10H10O2,A正确;由肉桂醇变为肉桂醛的过程属于氧化反应,应该在电解池的阳极生成,B错误;根据结构简式可知![]() ,1mol苯环与3mol氢气加成,1mol碳碳双键与1mol氢气加成,共消耗氢气4 mol,C正确;苯环与碳碳双键中的一个碳原子直接相连,CH3OOC-与碳碳双键上的另外一个碳原子直接相连,单键可以旋转,因此肉桂酸甲酯中所有碳原子可能在同一平面内,D正确;正确选项B。
,1mol苯环与3mol氢气加成,1mol碳碳双键与1mol氢气加成,共消耗氢气4 mol,C正确;苯环与碳碳双键中的一个碳原子直接相连,CH3OOC-与碳碳双键上的另外一个碳原子直接相连,单键可以旋转,因此肉桂酸甲酯中所有碳原子可能在同一平面内,D正确;正确选项B。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_____________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。