题目内容
13.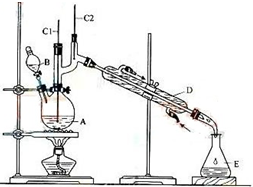 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2O$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$HCH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A
中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,简述理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润洗b.干燥 c.查漏
(4)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化.
(5)正丁醇的同分异构体有许多种,请写出符合下列条件的正丁醇的同分异构体:(1)含有与正丁醇相同的官能团;(2)一定条件下能被氧化成醛.(CH3)2CHCH2OH
(6)本实验中正丁醛的产率为51%.
分析 (1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅;
(2)根据装置图可知仪器的名称;
(3)分液漏斗使用前必须进行的第一项操作是检漏;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(5)根据条件 (1)含有与正丁醇相同的官能团,即有醇羟基,(2)一定条件下能被氧化成醛,说明羟基连在CH2上,据此写出符合条件的正丁醇的同分异构体;
(6)设正丁醛的理论产量为xg,根据关系式C4H10O~C4H8O列计算出理论产量,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)因为浓硫酸的密度大,能将Na2Cr2O7溶液加到浓硫酸中,容易发生迸溅伤人,
故答案为:不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人;
(2)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管,
故答案为:分液漏斗,直形冷凝管;
(3)分液漏斗使用前必须进行的第一项操作是检漏,故选c;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化;
(5)根据条件 (1)含有与正丁醇相同的官能团,即有醇羟基,(2)一定条件下能被氧化成醛,说明羟基连在CH2上,则符合条件的正丁醇的同分异构体为(CH3)2CHCH2OH,
故答案为:(CH3)2CHCH2OH;
(6)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=$\frac{74×2}{72×4}$×100%=51%,
故答案为:51%.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为x;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;Ⅴ.浓缩、结晶、分离,得到产品.
(1)将MnO4-氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(2)已知:生成氢氧化物沉淀的pH(注:金属离子的起始浓度为0.1mol•L-1)
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | / |
(3)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.

各离子开始沉淀和完全沉淀的pH值
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀~沉淀完全的pH | 2.7~4.1 | 3.7~5.2 | 7.5~9.6 | 8.6~10.1 | 9.6~11.1 |
请回答下列问题:
(1)步骤①可在如图装置中进行,仪器A的名称是三颈烧瓶;
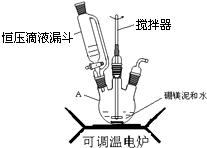
(2)本实验中多次用到抽滤,相比普通过滤,抽滤的优点是速度快、得到的滤渣较干燥;
(3)步骤②中加硼镁泥的作用是消耗多余的硫酸使pH增加到5~6,促使Fe3+、Al3+完全沉淀,NaClO的作用是氧化Fe2+、Mn2+;
(4)步骤③趁热过滤的目的是防止析出MgSO4•7H2O该过程中温度应控制在80℃左右;
(5)步骤④的具体操作:当出现晶膜时即停止加热,其原因是防止MgSO4•7H2O失去结晶水.
| A. | 容器中含D物质的量至少为0.45 mol | |
| B. | A的平均反应速率是0.010 mol•L-1•s-1 | |
| C. | 容器中A、B、C、D的物质的量之比一定是4:5:4:6 | |
| D. | 容器中A的物质的量一定增加了0.30 mol |
| A. | C2H4、C3H8 | B. | CH4、C3H8 | C. | CH4、C4H10 | D. | C2H2、C3H8 |

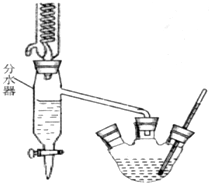 已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:
已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题: