题目内容
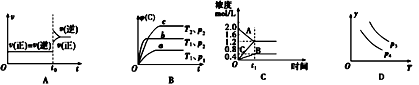
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
【答案】B
【解析】A、a点所得溶液中对H2A有:K1=c(H+)c(HA-)/c(H2A),10-1.85=10-1.85×c(HA-)/c(H2A)可得HA-与H2A的浓度相等,当V0=10mL时,生成的NaHA和剩余的H2A的物质的量相等,a点溶液显酸性,H2A的电离程度大于HA-的水解程度,故V0=10mL时混合溶液中的HA-和H2A的浓度不会相等,V0<10mL时才可能相等,A错误;B、C点所得溶液中:对HA-有K2=c(H+)xc(A2-)/c(HA-),10-7.19=10-7.19×c(A2-)/c(HA-)解得A2- 的浓度与HA-的浓度相等,B正确;C、b点加入的NaOH溶液体积为20mL,NaOH与H2A恰好完全反应生成NaHA,根据质子守恒有:c(H2A)+c(H+)=c(A2-)+ c(OH-),C错误;D、d点加入的NaOH的物质的量为H2A的物质的量的2倍,恰好生成Na2A,此时A2-第一步水解生成HA-,第一步水解的常数与H2A的第二电离常数的乘积为水的离子积常数,故第一步水解常数K1=1.0×10-14÷10-7.19=10-6.81,D错误。正确答案为B。

【题目】现有5瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、葡萄糖中的一种。现通过如下实验来确定各试剂瓶中所装液体的名称:
实验步骤和方法 | 实验现象 |
①把5瓶液体分别依次标号A、B、C、D、E,然后闻气味 | 只有E没有气味 |
②各取少量于试管中 ,加水稀释 | 只有C、D不溶解而浮在水面上 |
③分别取少量5种液体于试管中,加新制Cu(OH)2并加热 | 只有B使沉淀溶解,E中产生砖红色沉淀 |
④各取C、D少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(1)写出这6种物质的名称。
A____________ B____________ C____________ D____________ E____________
(2)在D中加入NaOH溶液并加热的化学方程式为__________________