题目内容
【题目】根据如图所示示意图,下列说法不正确的是( )
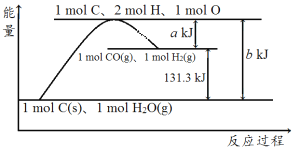
A.反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.amol C和amol H2O(l)反应生成amol CO和a mol H2吸收的热量一定为131.3a kJ
D.1mol C、2mol H、1mol O转变成1mol CO(g)和1mol H2(g)放出的热量为a kJ
【答案】C
【解析】
A. 由图可知,反应物总能量小于生成物总能量,为吸热反应,且焓变等于(ba)kJmol1,结合状态及焓变可知热化学方程式为C(s)+H2O(g)═CO(g)+H2(g) △H=(ba)kJmol1,故A正确;
B. 焓变等于断裂化学键吸收的能量减去成键释放的能量,该反应为吸热反应,焓变为正,则反应物断键吸收的能量大于生成物成键放出的能量,故B正确;
C. 热量与物质的状态有关,amolC和amolH2O(l)反应生成amolCO和amolH2,生成CO与H2不清楚状态,因此吸收的热量不一定等于131.3akJ,故C错误;
D. 形成化学键释放能量,由图可知,1molC(g)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ,故D正确。
综上所述,答案为C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D