题目内容
【题目】称取14.2 g 无水硫酸钠固体(摩尔质量为142 g/mol)溶于适量水中,再稀释至100 mL。回答下列问题:
(1)从配制所得的溶液中取出50 mL,该50 mL的溶液中硫酸钠的物质的量浓度为:___________
(2)写出硫酸钠在水溶液中的电离方程式:________。
(3)14.2 g该固体中含有钠离子的数目是:__________。
【答案】1 mol/L Na2SO4=2Na++SO42- 1.204×1023(或0.2NA)
【解析】
(1)先根据n=![]() 计算硫酸钠的物质的量,再根据物质的量浓度公式c=
计算硫酸钠的物质的量,再根据物质的量浓度公式c=![]() 计算溶液的物质的量浓度,利用溶液浓度的均一性,所取溶液浓度与原溶液浓度一样,与所取溶液的体积大小无关;
计算溶液的物质的量浓度,利用溶液浓度的均一性,所取溶液浓度与原溶液浓度一样,与所取溶液的体积大小无关;
(2)硫酸钠是强电解质,能完全电离出钠离子和硫酸根离子,据此书写电离方程式;
(3)然后根据溶质的分子式与其电离产生离子的关系结合N=n·NA计算离子的数目。
(1)硫酸钠的物质的量n(Na2SO4)=![]() =0.1 mol,则该溶液的物质的量浓度c=
=0.1 mol,则该溶液的物质的量浓度c=![]() =1 mol/L,从配制所得的溶液中取出50 mL,由于溶液具有均一性,即溶液的各处浓度相同,与溶液的体积无关,所以该50 mL的溶液中硫酸钠的物质的量浓度为1 mol/L;
=1 mol/L,从配制所得的溶液中取出50 mL,由于溶液具有均一性,即溶液的各处浓度相同,与溶液的体积无关,所以该50 mL的溶液中硫酸钠的物质的量浓度为1 mol/L;
(2)Na2SO4是盐,属于强电解质,完全电离产生Na+、SO42-,所以其电离方程式为:Na2SO4=2Na++SO42-;
(3)硫酸钠的物质的量n(Na2SO4)=![]() =0.1 mol,1个Na2SO4电离产生2个Na+、1个SO42-,所以14.2 g该固体中含有钠离子的数目N(Na+)=0.1 mol×2×6.02×1023/mol=1.204×1023。
=0.1 mol,1个Na2SO4电离产生2个Na+、1个SO42-,所以14.2 g该固体中含有钠离子的数目N(Na+)=0.1 mol×2×6.02×1023/mol=1.204×1023。

【题目】室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol·L-1 HA溶液中逐滴加入0.1000mol·L-1的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
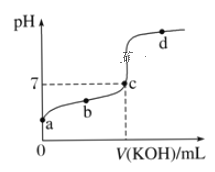
(1)a、b、c、d四点中水的电离程度最大的是_______点,滴定过程中宜选用__________作指示剂,滴定终点在__________(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_____(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
(4)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。