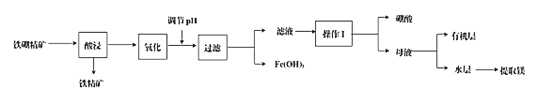
��Ŀ����
����Ŀ�����仯�����ڹ�ҵ��ҽҩ��ũҵ�Ȳ�����������;��ij����������(��Ҫ�ɷ�ΪB2O3��2MgO������SiO2��CaO��FeO������)��ȡ�����ᡢ����þ�Ĺ�������ͼΪ��
��֪�������ڲ�ͬ�¶��µ��ܽ�ȣ�
�¶�(��) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
�ܽ��(g/100gˮ) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
�ش��������⣺
(1)ʹ�������������������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_________��Ϊ��߽������ʣ��ɲ�ȡ�Ĵ�ʩ��_________(д������)��
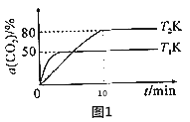
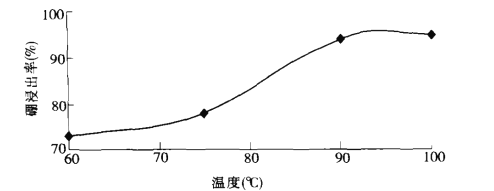
(2)���ʱ���¶���������ʵĹ�ϵ��ͼ��ʾ������ʵ�����¶�Ϊ_________��
(3)����Һ�����������ǽ���Һ�е�Fe2+��_______�Լ�����ΪFe3+����Ӧ�����ӷ���ʽΪ_________��
(4)����Һ�л��H3BO3�����������I�����������_________��
(5)����Һ�м����л���ȡ����ȡ��Һ����ʱ���ᴦ��_________����(�����л�����������)��ʵ����ģ����ȡ����ʹ�õIJ����������ձ��⣬��һ��Ҫ����������_________��
(6)ij������ m1 kg�������Ʊ����ᣬ�õ�����Ϊ99.8%������m2 kg�����������������������__________(��ʽ����)��
���𰸡�B2O3��2MgO+4HCl+H2O=2H3BO3+2MgCl2 �ʵ���������Ũ�ȡ���߷�Ӧ�¶ȡ���С��������������ֽ���� 90~95�� H2O2(��Cl2) 2Fe2++H2O2+2H+=2Fe3++2H2O(��2Fe2++Cl2=2Fe3++2Cl-) ����Ũ������ȴ�ᾧ������ �л� ��Һ©�� ![]() ��100%
��100%
��������
�������������Ҫ�ɷ�B2O3��2MgO������Ӧ����H3BO3��MgCl2������CaO��FeOҲ�ᷢ����Ӧ����CaCl2��FeCl2�����˳�ȥSiO2��Ȼ����Ӧ�����Һ�м���H2O2��ͨ��Cl2������������ԭ��Ӧ��FeCl2��ΪFeCl3��Ȼ�������ҺpHʹFe3+��Ӧת��ΪFe(OH)3���������˳�ȥ�����������ܽ�����¶ȵĹ�ϵ�������ᾧ�����Һ�з��������������ĸҺ�м����л�����ȡ���õ���ˮ���к���Mg2+��˵���������л����У�Ȼ������BԪ���غ�����������������������
(1)ʹ�����������������Ҫ��ӦΪ�������Ҫ�ɷ�B2O3��2MgO�����ᷢ����Ӧ����H3BO3��MgCl2����Ӧ�Ļ�ѧ����ʽΪB2O3��2MgO+4HCl+H2O=2H3BO3+2MgCl2�������ǹ������ʣ�Ϊ��߽������ʣ��ɲ�ȡ�Ĵ�ʩ���Խ�������飬Ҳ������߷�Ӧ�¶ȡ�ʹ�ýϴ�Ũ�ȵ����ᡢ��Ӧ�����н���ȣ�
(2)�����ʱ���¶���������ʵĹ�ϵͼʾ��֪����90~95��ʱ�����������ߣ����Ժ��ʵ�����¶�Ϊ90~95�棻
(3)����Һ��������������Һ�е�Fe2+�������������в��������µ����ʣ�����ʹ��H2O2��Ҳ����ʹ��Cl2ˮ����Ӧ����ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O(��2Fe2++Cl2=2Fe3++2Cl-)��
(4)��������ܽ�����¶ȵĹ�ϵ��֪���¶����ߣ�������ܽ���������Դ���Һ�л��H3BO3�����������I����������ǽ������µ���Һ����Ũ����Ȼ����ȴ�ᾧ���ٽ��й��˿ɵã�
(5)��������ᾧ������Һ����Ȼ����һ���������ᣬ�����Һ�����л���ȡ����ȡ��Һ�����ڵõ���ˮ���к��п��ܵ�MgCl2��˵���������л����У����������ܽ��ڸ��л���ȡ���У�ʵ����ģ����ȡ����ʹ�õIJ����������ձ��⣬��һ��Ҫ���������Ƿ�Һ©����
(6)����Ϊ99.8%������m2kg�к���BԪ�ص�����Ϊm(B)=![]() kg�����ڲ���������������m1kg������ ���������������������
kg�����ڲ���������������m1kg������ ���������������������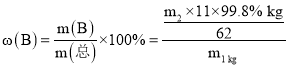 ��100%=
��100%=![]() ��100%��
��100%��

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�