题目内容
【题目】在不同温度下,向2 L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
【答案】D
【解析】A、根据题中所给已知条件可知:
2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,
开始时的浓度/ mol/L 0.5 0.5 0 0
改变(T1)的浓度/ mol/L 0.3 0.15 0.15 0.15
T1时的浓度/ mol/L 0.2 0.35 0.15 0.15
改变(T2)的浓度/ mol/L 0.25 0.125 0.125 0.125
T1时的浓度/ mol/L 0.25 0.375 0.125 0.125
K(T1)= ![]() =0.5625;K(T2)=
=0.5625;K(T2)= ![]() =0.25;
=0.25;
因 K(T1)> K(T2) 故温度T1<T2,选项A正确;B、T1℃时,该反应的平衡常数K=![]() = =
= =![]() =0.5625,选项B正确;C、T2℃时,若反应达平衡后再缩小容器的体积,相当于增大压强,该反应为等体积反应,改变压强,平衡不发生移动,故c(N2) :c (NO)不变,选项C正确;D、T1℃时,若开始时反应物的用量均减小一半,平衡逆向移动,NO的转化率减小,选项D错误。答案选D。
=0.5625,选项B正确;C、T2℃时,若反应达平衡后再缩小容器的体积,相当于增大压强,该反应为等体积反应,改变压强,平衡不发生移动,故c(N2) :c (NO)不变,选项C正确;D、T1℃时,若开始时反应物的用量均减小一半,平衡逆向移动,NO的转化率减小,选项D错误。答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】有一种细菌在酸性水溶液中,有氧气的情况下,可以将黄铜矿(主要成分是CuFe![]() ,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
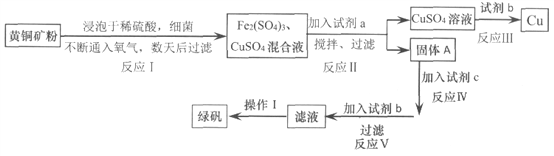
已知:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
回答下列问题:
(1)试剂a是_________,调节溶液的pH值,为使Fe3+完全沉淀,合适pH的范围是_______。
(2)试剂b为________,请写出反应III的离子方程式________________。
(3)固体A成份是________。
(4)欲从滤液中获得绿矾晶体,操作I应为________________、洗涤干燥。
(5)反应I中参加反应的n(CuFeS2):n(O2)=________________。





