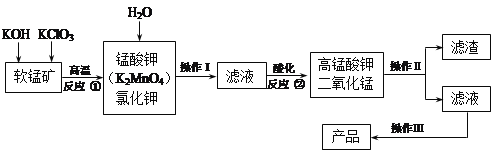
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1mol MaHSO4熔化或溶于水时电离出来的离子总数均为3NA
B. 0.1 mol NO和0.1 molO2充分反应,转移的电子数目为0.2NA
C. 常温下,1 L pH=2的CH3COOH溶液中含有的氢原子数目小于0.1NA
D. 100g质量分数为46%的乙醇溶液中含有的氢原子数目为6NA
【答案】B
【解析】A. 1mol MaHSO4熔化或溶于水时电离出来的离子总数分别为2NA和3NA,A错误;B. 0.1 mol NO和0.1 molO2充分反应生成0.1molNO2,氧气过量,转移的电子数目为0.2NA,B正确;C. 常温下,1 L pH=2的CH3COOH溶液中含有的氢原子数目大于0.1NA,因为溶剂水还含有大量氢原子,C错误;D. 100g质量分数为46%的乙醇溶液中含有的氢原子物质的量是![]() ,数目为12NA,D错误,答案选B。
,数目为12NA,D错误,答案选B。

【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
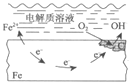
【题目】下列说法中,不正确的是
A | B | C | D |
|
|
|
|
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸性较强,发生析氢腐蚀 | 将锌板换成铜板对钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
A. A B. B C. C D. D
【题目】在不同温度下,向2 L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
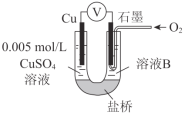
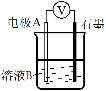
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_________;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是_________。
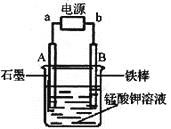
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的_________影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_________。
④为达到丁同学的目的,经讨论,同学们认为应改用右图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是_________。