题目内容
【题目】在微电子工业中 NF3 常用作氮化硅的蚀刻剂,工业上通过电解含 NH4F 等的无水熔融物生产NF3,其电解原理如图。下列说法不正确的是( )
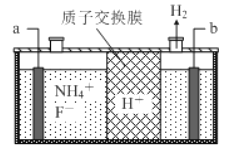
A. a 电极为电解池的阳极
B. 阳极的电极反应式: NH4++3F--6e—===NF3+4H+
C. H+由b极移向a极,并参与电极反应
D. 电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为 F2
【答案】C
【解析】A、根据图中信息可知,氢离子在b极得电子产生氢气,故b极为阴极,a极为阳极,选项A正确;B、阳极铵根离子得电子产生NF3,其电极反应式为NH4++3F--6e—=NF3+4H+,选项B正确;C、电解池中阳离子定向移动到阴极,故H+由a极移向b极,并参与电极反应H++2e—=H2↑,选项C不正确;D、当氟离子浓度较大时,氟离子失电子产生氟气,选项D正确。答案选D。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
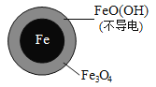
(1)Fe还原水体中NO3-的反应原理如图所示。
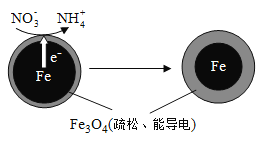
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
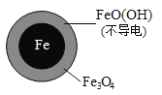
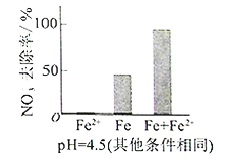
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
【题目】在不同温度下,向2 L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小