题目内容
【题目】Glaser反应在研究新型发光材料、超分子化学等方面具有重要价值。一定条件下丙炔(CH≡CCH3)发生Glaser反应制备CH3C≡C—C≡CCH3时,主要副产物为CH3CH2CH3,发生的反应为
I.2CH≡CCH3(g)![]() CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
II.CH≡CCH3(g)+2H2(g)![]() CH3CH2CH3(g) △H2=-179kJ·mol-1
CH3CH2CH3(g) △H2=-179kJ·mol-1
请回答:
(1)反应II的平衡常数表达式K=__________。
(2)为提高CH3C≡C—C=CCH3的产率,可采取的措施为______(任写两条)。
(3)己知:C—H、H —H 的键能分别为414 kJ·mol-1、436 kJ·mol-1,则C—C 的键能为____ kJ·mol-1。
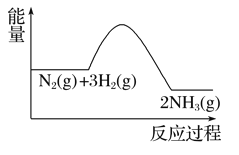
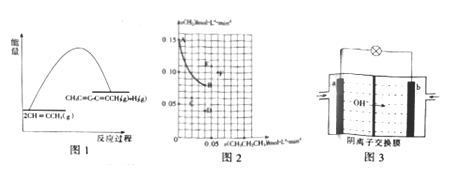
(4)欲提高反应I的速率,向其中加入傕化剂,使该反应分两步进行,且均为吸热反应。下如图为未加催化剂时反应I的能量变化图,请画出加入催化剂后反应过程的能量变化图_____________。
(5)一定温度下,向某恒容密闭容器中充人一定量的CH≡CCH3(g)+2H2(g),发生反应II。一段时间内测定CH3CH2CH3(g)与H2(g)的消耗速率,二者关系如下如图中AB曲线所示。B点时,该反应_________(填“是”或“否”)达到平衡状态,原因为_____________;若此时升高温度,二者速率关系相应的点可能为______________(填字母)。
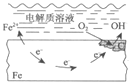
(6) CH3CH2CH3碱性燃料电池是一种高性能燃料电池,其工作原理如下如图所示。b电极为________(填“正极”或“负极”),该电极的反应式为_______________。
【答案】 ![]() 选择合适催化剂(重点说明催化剂的选择性)、适当升高温度,移出H2等 332
选择合适催化剂(重点说明催化剂的选择性)、适当升高温度,移出H2等 332  是 B点时H2的消耗速率与CH3CH2CH3的消耗速率之比为2︰1 F 负极 CH3CH2CH3 + 26OH - -20e- = 3CO32- + 17H2O
是 B点时H2的消耗速率与CH3CH2CH3的消耗速率之比为2︰1 F 负极 CH3CH2CH3 + 26OH - -20e- = 3CO32- + 17H2O
【解析】(1)根据反应II的方程式可知平衡常数表达式K=![]() 。(2)正反应是体积不变的放热反应,又因为存在副反应,因此为提高CH3C≡C—C≡CCH3的产率,可采取的措施为选择合适催化剂、适当升高温度,移出H2等。(3)设碳碳三键的键能是xkJ/mol,C—C 的键能为ykJ/mol,则根据反应Ⅰ可知2×(4×414+x+y)-6×414-2x-3y-436=60,解得y=332。(4)催化剂能降低反应的活化能,则加入催化剂后反应过程的能量变化图为
。(2)正反应是体积不变的放热反应,又因为存在副反应,因此为提高CH3C≡C—C≡CCH3的产率,可采取的措施为选择合适催化剂、适当升高温度,移出H2等。(3)设碳碳三键的键能是xkJ/mol,C—C 的键能为ykJ/mol,则根据反应Ⅰ可知2×(4×414+x+y)-6×414-2x-3y-436=60,解得y=332。(4)催化剂能降低反应的活化能,则加入催化剂后反应过程的能量变化图为 ;(5)由于B点时H2的消耗速率与CH3CH2CH3的消耗速率之比为2︰1,所以该反应达到平衡状态;若此时升高温度,正逆反应速率均增大,平衡向逆反应方向减小,因此二者速率关系相应的点可能为F。(6)氢氧根向b电极移动,所以b电极为负极,该电极丙烷发生失去电子的氧化反应,反应式为CH3CH2CH3+26OH= -20e-= 3CO32-+17H2O。
;(5)由于B点时H2的消耗速率与CH3CH2CH3的消耗速率之比为2︰1,所以该反应达到平衡状态;若此时升高温度,正逆反应速率均增大,平衡向逆反应方向减小,因此二者速率关系相应的点可能为F。(6)氢氧根向b电极移动,所以b电极为负极,该电极丙烷发生失去电子的氧化反应,反应式为CH3CH2CH3+26OH= -20e-= 3CO32-+17H2O。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
【题目】下列说法中,不正确的是
A | B | C | D |
|
|
|
|
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸性较强,发生析氢腐蚀 | 将锌板换成铜板对钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
A. A B. B C. C D. D
【题目】在不同温度下,向2 L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小