题目内容
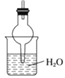
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用___________(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的______(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_________试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放______溶液(填化学式),反应的离子方程式为_____。
【答案】 ace II或III 用热毛巾将烧瓶捂热片刻 饱和食盐水、浓硫酸 3C12+8NH3=6NH4Cl+N2 NaOH Cl2+2OH-=Cl-+ClO-+H2O
【解析】(1)浓氨水与氢氧化钠、生石灰等反应可以制备氨气;
(2)根据氨气极易溶于水和喷泉实验原理分析;
(3)①根据氯气中含有氯化氢和水蒸气分析;
②根据实验现象判断生成物;
③氯气需要用氢氧化钠溶液吸收。
(1)浓氨水中存在以下平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),使平衡逆向移动,同时反应放热,促进NH3·H2O的分解,因此装置A中烧瓶内试剂可选用碱石灰、生石灰和烧碱,答案选ace。
NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),使平衡逆向移动,同时反应放热,促进NH3·H2O的分解,因此装置A中烧瓶内试剂可选用碱石灰、生石灰和烧碱,答案选ace。
(2)由于氨气极易溶于水,若探究氨气的溶解性,需要有防倒吸装置,Ⅰ导管直接插入水中,会产生倒吸,因此需在K2的导管末端连接下表装置中的II或III装置;当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是用热毛巾将烧瓶捂热片刻,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
(3)①用二氧化锰与浓盐酸制取氯气,生成的氯气中含有氯化氢和水蒸气,则生成气体必须依次通过盛有饱和食盐水、浓硫酸试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,说明有氯化铵生成,同时生成一种无色无味的气体,根据原子守恒可知应该是氮气,因此该反应的化学方程式为3C12+8NH3=6NH4Cl+N2。
③氯气有毒,需要尾气处理,则C装置中应盛放NaOH溶液,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

【题目】下列实验中,对应的现象和结论都正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 常温下,质量和形状相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 某食盐溶液中加入淀粉溶液 | 溶液不变蓝 | 该食盐样品中一定不含KIO3 |
C | SO2通入BaCl2 溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
D | 将少量大理石粉未加入1.0mol/L的NH4Cl 溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
A. A B. B C. C D. D