��Ŀ����
����Ŀ��ͭ�����������ܡ����仯�����ڹ�ҵ������Ҫ��;���ش��������⣺
��1��������(Fe3+)���������Ų�ʽΪ______��������______�ֲ�ͬ�˶�״̬�ĵ��ӡ�Fe3+��Fe2+���ȶ���ԭ����____________________________________��
��2����Ϊ��������Ԫ�أ����ڵ�Ԫ��������壬������Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ________(��Ԫ�ط��ű�ʾ)��
��3��Na3[Co(NO2)6]����������K+���Լ���Na3[Co(NO2)6]�д��ڵĻ�ѧ����__________��
��4��������PCl5��һ�ְ�ɫ���壬��������ϵ����ṹģ��������ͼ��ʾ����A��B���������ɡ����������148���ۻ����γ�һ���ܵ�������塣��֪A��B�������ֱ���CCl4��SF6��Ϊ�ȵ����壬��AΪ______��������ԭ���ӻ��������Ϊ__________��BΪ________��
��5������������ͼ��ʾ��A1ԭ�ӵ���λ��Ϊ________����������ԭ��֮����������Ϊd pm��NA���������ӵ�������ֵ�� ������������ܶȦ�=_________g/cm3��


���𰸡� 3s23p63d5 23 Fe3+�ĵ����Ų�Ϊ[Ar]3d5,3d���Ϊ�����״̬����Fe2+�����Ų�[Ar]3d6���ȶ� Br>Se>As ��λ�������ۼ������Ӽ� PCl4+ sp3 PCl6- 4 ![]() ��1030
��1030
����������1��FeΪ26��Ԫ�أ�Fe3+�ĺ�������Ų�ʽΪ[Ar] 3d5�����������Ų�ʽΪ3s23p63d5��������2�ֲ�ͬ�˶�״̬�ĵ��ӣ�Fe3+�ĺ�������Ų�ʽΪ[Ar] 3d5��3d���Ϊ�����״̬����Fe2+�����Ų�[Ar]3d6���ȶ�����2��As��Se��Br����ͬһ������ԭ������������Ԫ�صķǽ���������ǿ���縺������ǿ������3��Ԫ�صĵ縺�ԴӴ�С˳��ΪBr��Se��As����3��Na3[Co(NO2)6]����������K+���Լ���Na3[Co(NO2)6]�д��ڵĻ�ѧ������λ�������ۼ������Ӽ�����4��A����CCl4������ͬ�ռ乹����Ӧ��ԭ������һ����5��ԭ���Ҽ۵���������ͬΪ32������Ӧ�ô�һ����λ����ɵ�PCl4+���ӣ���BΪ������ɵ�PCl6-���ӣ�PCl4+��Pԭ���γ�4���ļ����¶Ե�����Ϊ![]() =1����Ϊsp3�ӻ�����5������������ͼ��ʾ��A1ԭ����4��Pԭ���γ��������壬����λ��Ϊ4��Alλ�ڶ�������ģ����Al�ĸ���Ϊ8��
=1����Ϊsp3�ӻ�����5������������ͼ��ʾ��A1ԭ����4��Pԭ���γ��������壬����λ��Ϊ4��Alλ�ڶ�������ģ����Al�ĸ���Ϊ8��![]() ��6��
��6��![]() =4��Pλ�����ģ���4���������Ļ�ѧʽΪAlP����˾���������Ϊ
=4��Pλ�����ģ���4���������Ļ�ѧʽΪAlP����˾���������Ϊ![]() g����������ԭ��֮����������Ϊd pm��Ϊ���ĵ�����ľ��룬��˾����ı߳�Ϊ
g����������ԭ��֮����������Ϊd pm��Ϊ���ĵ�����ľ��룬��˾����ı߳�Ϊ![]() pm=
pm=![]() ��10-10cm�������ܶȵĶ��壬�������ܶ�Ϊ
��10-10cm�������ܶȵĶ��壬�������ܶ�Ϊ ![]() ��1030g/cm3��
��1030g/cm3��
���磺�����������Ų����ӻ�������͡��ռ乹�͡��ܽ��ԡ��ȵ������Լ������ṹ��������㡣ע�⾧��Ľṹ������������ʣ���������ʷ�ӳ�˾���Ľṹ�����ʵ���ɺͽṹ���жϾ������͵ĸ������ݣ��ڸ������ʵ����ʺ�����жϾ�������ʱ��Ҫ���ǵ���ͬ���ʵ����ԣ���һ����������������Ӿ��壬��AlCl3�Ƿ��Ӿ��壬ԭ�Ӿ���һ�㲻���磬��������ܵ���ȡ������ٽ��о�������ʱҪ���Ӧ�þ�̯����ע�����ճ����ľ��������ص�;����ṹ��

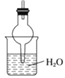
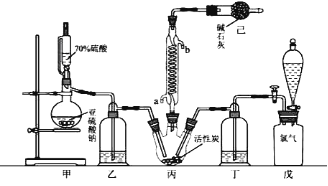
����Ŀ��ij��ѧ��ȤС��������ͼװ����ȡ������̽���������й����ʡ�

(1)װ��A����ƿ���Լ���ѡ��___________������ţ���
a����ʯ�� b��Ũ���� c����ʯ�� d������������ e���ռ����
(2)��̽���������ܽ��ԣ�����K2�ĵ���ĩ�������±�װ���е�______������ţ�װ�ã���װ��D�м��������ر�K1��K2����K3��������Ȫ��ʵ�������________��
��ѡװ�ã�����ˮ�к���̪��Һ�� | ||
|
|
|
�� | �� | �� |
(3)��̽�������Ļ�ԭ�ԣ����K1��K3��K,2������������ȡ����������������װ�á�
���ö���������Ũ������ȡ���������������ͨ��ʢ��_________�Լ���ϴ��ƿ��
��D�а�����������Ӧ�������̣�ͬʱ����һ����ɫ��ζ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ_________��
�۴�K3�������ݳ��������к�������C12����Cװ����Ӧʢ��______��Һ���ѧʽ������Ӧ�����ӷ���ʽΪ_____��
����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����a | ��̿���ڸ��������»�ԭCuO |
����b | ��ⷨ����ӦΪ2Cu+H2O |
��1����ҵ�ϳ��÷���b��ȡCu2O�������÷���a����ԭ���Ƿ�Ӧ���������ƣ������²���������__��ʹCu2O���ʽ��͡�
��2����֪��
��2Cu(s)+ ![]() O2(g)
O2(g)![]() Cu2O(s) ��H1=��169 kJ��mol��1
Cu2O(s) ��H1=��169 kJ��mol��1
��C(s)+ ![]() O2(g)
O2(g)![]() CO(g) ��H2=��110.5 kJ��mol��1
CO(g) ��H2=��110.5 kJ��mol��1
��Cu(s)+![]() O2(g)
O2(g)![]() CuO(s) ��H3=��157 kJ��mol��1
CuO(s) ��H3=��157 kJ��mol��1
��a�з����ķ�Ӧ��2CuO(s)��C(s)= Cu2O(s)��CO(g)����H=________��
��3������b������ȼ�ϵ��Ϊ��Դ��ͨ�����ӽ���Ĥ��ⷨ���Ƶ��Һ��OH����Ũ�����Ʊ�����Cu2O��װ����ͼ��ʾ��
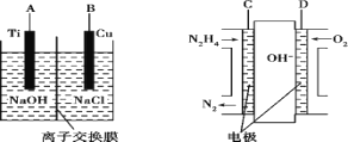
������װ����B�缫Ӧ��_________�缫(�C����D��)��
�ڸ����ӽ���ĤΪ____���ӽ���Ĥ(�����������)���õ��ص�������ӦʽΪ_______��
��ԭ����и�����ӦʽΪ______________��
��4������ͬ����ĺ����ܱ������У������Ϸ����Ƶõ�����Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺2H2O(g) ![]() 2H2(g)+O2(g) ��H>0��ˮ������Ũ����ʱ��t�ı仯���±���ʾ��
2H2(g)+O2(g) ��H>0��ˮ������Ũ����ʱ��t�ı仯���±���ʾ��
��� | �¶�/��c/mol��L-1t/min | 0 | 10 | 20 | 30 | 40 | 50 |
�� | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
�� | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
�� | T2 | 0.10 | 0.096 | 0.093 | 0.090 | 0.090 | 0.090 |
�ٴ����Ĵ�Ч��:ʵ���_______ʵ���(�>����<��)��
��ʵ��١��ڡ��۵Ļ�ѧƽ�ⳣ��K1��K2��K3�Ĵ�С��ϵΪ________��
����Ŀ��CH4��H2��C�������ʵ���Դ���ʣ�����ȼ�յ��Ȼ�ѧ����ʽΪ��
��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��890.3kJmol��1
��2H2��g��+O2��g���T2H2O��l����H=��571.6kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��1������д���һ�ּ���ϸ������������øʹ������O2���ò���������������ϸ��ʹ1mol��������CO2������Һ̬ˮ���ų����������������������=����890.3kJ��
��2��������CO2�����ںϳɺϳ�������Ҫ�ɷ���һ����̼����������CH4+CO2�T2CO+2H2 �� 1g CH4��ȫ��Ӧ���ͷ�15.46kJ����������
���ܱ�ʾ�÷�Ӧ�����������仯���ǣ�ͼ1��������ĸ����
���������ʵ�����Ϊ1mol��CH4��CO2����ij�����ܱ������У���ϵ�ų�����������ʱ��ı仯��ͼ2��ʾ����CH4��ת����Ϊ �� 
��3��C��s����H2��g������Ӧ������C��s��+2H2��g���TCH4��g���ķ�Ӧ����ֱ�Ӳ�������ͨ��������Ӧ�����C��s��+2H2��g���TCH4��g���ķ�Ӧ�ȡ�H= ��
��4��Ŀǰ���������������ʵ��о���ȼ���о����ص㣬���й��������������ʵ��о������п��е���������ĸ����
A.Ѱ�����ʴ�����ʹCO2��H2O��Ӧ����CH4��O2 �� ���ų�����
B.Ѱ�����ʴ������ڳ��³�ѹ��ʹCO2�ֽ�����̼��O2
C.Ѱ�����ʴ���������̫����ʹ�����е�CO2�뺣���ɵ�CH4�ϳɺϳ�����CO��H2��
D.����̬̼�ϳ�ΪC60 �� ��C60��Ϊȼ��
��5����ҵ�Ϻϳɼ״��ķ�Ӧ��CO��g��+2H2��g��CH3OH��g����H=��90.8kJmol��1 �� �����¶���ͬ���ݻ���Ϊ2L��3�������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�����
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 1molCO��2mol H2 | 1mol CH3OH | 2mol CO��4mol H2 |
CH3OH��Ũ�ȣ�mol/L�� | c1=0.25 | c2 | c3 |
��Ӧ�������仯 | �ų�Q1 kJ | ����Q2 kJ | �ų�Q3 kJ |
ƽ�ⳣ�� | K1 | K2 | K3 |
��Ӧ��ת���� | ��1 | ��2 | ��3 |
�����в���˵���÷�Ӧ�ں��º����������Ѵﻯѧƽ��״̬���� ��
A��v����H2��=2v����CH3OH�� B��n��CO���sn��H2���sn��CH3OH��=1�s2��1
C�����������ܶȲ��� D����������ƽ����Է����������� E��������ѹǿ����
������˵����ȷ���� ��
A��c1=c2 B��Q1=Q2 C��K1=K2 D����2+��3��100%
����ͼ��ʾ�÷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵͼ��ͼ3����
���ε�ƽ�ⳣ�������ʾ��
t2��t3 | t4��t5 | t5��t6 | t7��t8 |
K4 | K5 | K6 | K7 |
K4��K5��K6��K7֮��Ĺ�ϵΪ�����������������=��������Ӧ���ת��������һ��ʱ���� ��