题目内容
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣ 个数为1 NA
B.标准状况下,11.2 L H2O 所含的分子数为0.5NA
C.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
D.18g H2O 和H2O2 的混合物含有的分子数为1NA
【答案】C
【解析】A、没有溶液体积,不能计算氯离子数,A不符合题意;
B、依据气体摩尔体积的条件应用分析,标准状况水不是气体,11.2L H2O物质的量不是0.5mol,B不符合题意;
C、依据n= ![]() 计算物质的量,n=
计算物质的量,n= ![]() =0.01mol,结合化学式得到钠离子数为0.02NA,C符合题意;
=0.01mol,结合化学式得到钠离子数为0.02NA,C符合题意;
D、依据极值方法结合n= ![]() 计算物质的量,18g H2O物质的量为1mol,18gH2O2的物质的量小于1mol,混合物含有的分子数小于1NA,D不符合题意;
计算物质的量,18g H2O物质的量为1mol,18gH2O2的物质的量小于1mol,混合物含有的分子数小于1NA,D不符合题意;
所以答案是:C.

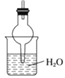
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用___________(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的______(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_________试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放______溶液(填化学式),反应的离子方程式为_____。
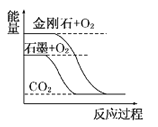
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3kJmol﹣1
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
③C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量(填“>”“<”或“=”)890.3kJ.
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2 , 1g CH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是(图1)(填字母).
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图2所示,则CH4的转化率为 . 
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H= .
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是(填字母).
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60 , 以C60作为燃料
(5)工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJmol﹣1 , 若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如表:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
平衡常数 | K1 | K2 | K3 |
反应物转化率 | α1 | α2 | α3 |
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是 .
A.v正(H2)=2v逆(CH3OH) B.n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
②下列说法正确的是 .
A.c1=c2 B.Q1=Q2 C.K1=K2 D.α2+α3<100%
③如图表示该反应的反应速率v和时间t的关系图(图3):
各阶段的平衡常数如表所示:
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K4 | K5 | K6 | K7 |
K4、K5、K6、K7之间的关系为(填“>”、“<”或“=”).反应物的转化率最大的一段时间是 .