题目内容
【题目】关于![]() 溶液,下列判断不正确的是 ( )
溶液,下列判断不正确的是 ( )
A. 粒子种类与![]() 溶液相同
溶液相同
B. 升高温度,![]() 增大
增大
C. 加入![]() 溶液,
溶液,![]() 减小
减小
D. ![]()
【答案】B
【解析】
从溶质的溶解直至水的电离,可知溶液中粒子种类;根据外因对化学平衡的影响分析浓度变化;由溶液的电中性原理可写电荷守恒关系。
A项:溶液中Na2CO3完全电离Na2CO3=2Na++CO32-,CO32-分两步水解CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH- ,水的电离H2O
H2CO3+OH- ,水的电离H2O![]() H++OH- 。同理可写出
H++OH- 。同理可写出![]() 溶液的各种过程,两溶液中粒子种类相同,A项正确;
溶液的各种过程,两溶液中粒子种类相同,A项正确;
B项:CO32-水解过程吸热,升高温度使水解平衡右移,![]() 减小,B项错误;
减小,B项错误;
C项:加入![]() 溶液,Ca2+与CO32-结合生成难溶于水的CaCO3沉淀,使
溶液,Ca2+与CO32-结合生成难溶于水的CaCO3沉淀,使![]() 减小,C项正确;
减小,C项正确;
D项:水溶液都是电中性的,符合电荷守恒![]() ,D项正确。
,D项正确。
本题选B。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
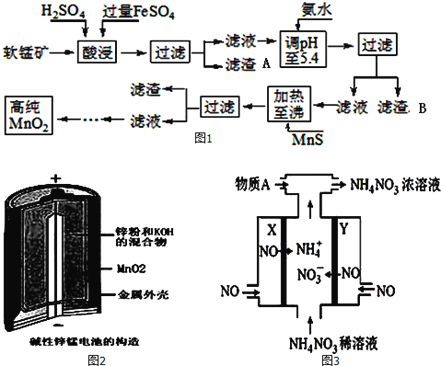
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;