题目内容
【题目】2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质。
 (反应明显放热)
(反应明显放热)

实验中可能用到的数据:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比3:1配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g。
(1)在烧杯中配制该实验所需混酸的方法是___。
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和___。
(3)分离产物的方案如下:

回答下列问题:
操作ii中会用到下列仪器中的___(填序号)。
a.温度计 b.蒸发皿 c.锥形瓶 d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为___。
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000molL-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg。
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该___。
②设计简单实验证明滤渣已经洗涤干净:___。
③原无机混合物中HNO3的浓度为___molL-1(用含V和W的代数式表示)。
【答案】分别量取10mL和30mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌 控制滴加混酸的速度 ac 53.2% 平视10.20mL的刻度线 取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净 0.1V-![]()
【解析】
⑴浓硫酸溶于水会放出大量的热,容易发生液体飞溅的情况,同时浓硝酸易挥发,混合一般是密度大的加入到密度小的里。
⑵控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度,操作ii是分离2-硝基甲苯和4-硝基甲苯,可以用蒸馏的方法,先求20.00 mL甲苯的物质的量,得出理论上产生硝基甲苯的质量,再计算产率。
⑷①量取过程中眼睛要平视酸式滴定管内液面;②滤渣表面可能有的杂质为氯离子;③先求NaOH的物质的量,也是原样品中混酸中氢离子的总物质的量,再求混酸中硫酸的物质的量,再求混酸中HNO3的物质的量,再求HNO3的浓度。
⑴浓硫酸溶于水会放出大量的热,容易发生液体飞溅的情况,同时浓硝酸易挥发,所以配制混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌;故答案为:分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌。
⑵控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度,操作ii是分离2-硝基甲苯和4-硝基甲苯,可以用蒸馏的方法,所以会用到温度计、锥形瓶,故选ac,20.00 mL甲苯的物质的量为![]() ,理论上产生硝基甲苯的质量为
,理论上产生硝基甲苯的质量为![]() ,所以产率为
,所以产率为![]() ;故答案为:控制滴加混酸的速度;ac;53.2%。
;故答案为:控制滴加混酸的速度;ac;53.2%。
⑷①取10.00 mL稀释液的过程中,酸式滴定管的初始液面为0.20 mL,则量取液体最终的刻度应为10.20 mL,所以量取过程中眼睛要注视酸式滴定管内液面是否达到10.20 mL的刻度,其操作为平视10.20 mL的刻度线;故答案为:平视10.20 mL的刻度线。
②滤渣表面可能有的杂质为氯离子,所以可以通过检验是否有氯离子来确定是否洗涤干净,其操作为取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净;故答案为:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净。
③V mL,0.1000molL-1NaOH溶液中NaOH的物质的量为V×10-4 mol,所以原样品中混酸中氢离子的总物质的量为![]() ,而混酸中硫酸的物质的量为
,而混酸中硫酸的物质的量为![]() ,所以混酸中HNO3的物质的量为
,所以混酸中HNO3的物质的量为![]() ,则HNO3的浓度为
,则HNO3的浓度为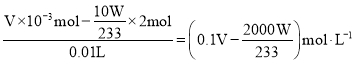 ;故答案为:
;故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案