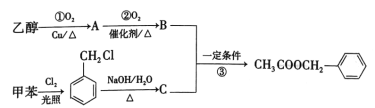
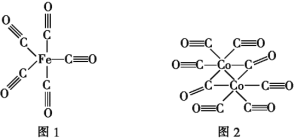
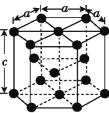
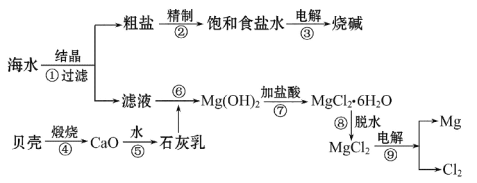
题目内容
【题目】为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:
实验 步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中; 2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3将一小段镁带投入稀盐酸中; 4将一小片铝投入稀盐酸中. |
实验 现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
(1)请在下表中填写与实验步骤对应的实验现象序号:
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)请写出镁与水反应的化学方程式:_______________。
(3)实验结论是___________________。
(4)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左至右原子的电子层数相同,随着核电荷数逐渐增多,原子半径逐渐_______,失电子能力逐渐_______,因此________逐渐减弱。
【答案】② ④ ① ③ ![]() 金属性:
金属性:![]() 减小 减弱 金属性
减小 减弱 金属性
【解析】
(1)越活泼的金属,和酸溶液或水反应越剧烈,置换出氢气越容易,生成碱的碱性越强,据此分析解答;
(2)镁与水在加热条件下能够反应生成氢氧化镁和氢气;
(3)根据以上反应现象判断金属钠、镁、铝的金属性强弱顺序;
(4)从原子半径和失电子能力角度来解释金属性强弱的关系。
(1)金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,所以:实验1对应的现象为②、实验2对应的现象为④、实验3对应的现象为①、实验4对应的现象为③,故答案为:②;④;①;③;
(2)镁在加热条件下与水反应的化学方程式为:Mg+2H2O![]() Mg(OH)2+H2↑,故答案为:Mg+2H2O
Mg(OH)2+H2↑,故答案为:Mg+2H2O![]() Mg(OH)2+H2↑;
Mg(OH)2+H2↑;
(3)根据金属和酸以及水的反应的剧烈程度,可以知道:金属活动性顺序为:Na>Mg>Al,故答案为:金属性:Na>Mg>Al;
(4)同周期元素从左到右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,故答案为:减小;减弱;金属活动性。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列对一些实验事实和理论解释正确的是
选项 | 实验事实 | 理论解释 |
A | HCl气体溶于水,能导电 | HCl为离子化合物 |
B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
C |
|
|
D | HF的沸点高于HCl | F的非金属性比Cl强 |
A.AB.BC.CD.D