题目内容
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co的价电子排布式为__,的I4(Co)__的I4(Fe)(填>、<或者=),原因是__。
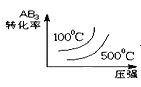
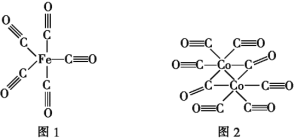
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中0.1molFe(CO)5含有配位键__个,写出2个与CO互为等电子体微粒__,图2中的σ键和π键个数之比是__(填元素符号)。
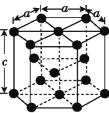
(3)金属钴的堆积方式为六方最密堆积,其配位数是__;该晶胞的边长为xnm,高为ynm,该晶胞的密度为__g·cm-3。(NA表示阿伏加德罗常数的值,列出代数式)
【答案】3d74s2 < Co失去三个电子后会变成[Ar]3d6,更容易再失去一个电子形成半满状态[Ar]3d5,Fe失去三个电子后会变成[Ar]3d5,达到半充满的稳定状态,更难再失去一个电子 6.02×1023(或NA) N2、CN- 19:14 12 ![]()
【解析】
(1)Co的原子序数为27,价电子排布式为3d74s2;Fe失去3个电子变为3d5,为半满稳定;
(2)Fe(CO)5中C原子和Fe原子之间形成配位键,-C≡O中C原子和O原子之间形成1个配位键;等电子体是原子个数和电子数均相等的粒子;一个单键含有1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键;
(3)六方最密堆积,配位数是12;钻晶体晶胞中顶点占![]() ,面心占
,面心占![]() ,体内占1,据此计算晶胞中原子个数;计算结构单元中原子总质量,利用
,体内占1,据此计算晶胞中原子个数;计算结构单元中原子总质量,利用![]() 进行计算;
进行计算;
(1)Co的原子序数为27,则Co核外电子排布式为:1s22s22p63s23p63d74s2,价电子排布式为:3d74s2;第四电离能I4(Co)<I4(Fe),其原因是铁失去的是较稳定的3d5的一个电子,钴失去的是3d6上的一个电子,易失去;故答案为:3d74s2;<;Co失去三个电子后会变成[Ar]3d6,更容易再失去一个电子形成半满状态[Ar]3d5,Fe失去三个电子后会变成[Ar]3d5,达到半充满的稳定状态,更难再失去一个电子;
(2)Fe(CO)5中C原子和Fe原子之间形成配位键,-C≡O中C原子和O原子之间形成1个配位键,所以0.1 mol Fe(CO)5含有1mol配位键,个数为6.02×1023(或NA);等电子体是原子个数和电子数均相等的粒子,CO含2个原子核14个电子,其等电子体可以是:N2、CN-;一个单键含有1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键,则图2中的σ键和π键个数之比是19:14
故答案为:6.02×1023(或NA);N2、CN-;19:14;
(3)六方最密堆积,配位数是12;钻晶体晶胞中顶点占![]() ,面心占
,面心占![]() ,体内占1,则该晶胞中原子个数为
,体内占1,则该晶胞中原子个数为![]() ,图中结构单元底面为正六边形,边长为x nm,底面面积为
,图中结构单元底面为正六边形,边长为x nm,底面面积为![]() ,结构单元的体积为
,结构单元的体积为![]() ,结构单元中原子总质量为
,结构单元中原子总质量为![]() ,则晶体密度
,则晶体密度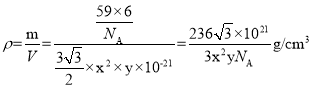 ,故答案为:12;
,故答案为:12;![]() 。
。

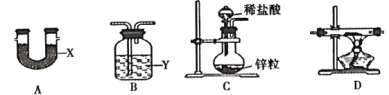
【题目】为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:
实验 步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中; 2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3将一小段镁带投入稀盐酸中; 4将一小片铝投入稀盐酸中. |
实验 现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
(1)请在下表中填写与实验步骤对应的实验现象序号:
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)请写出镁与水反应的化学方程式:_______________。
(3)实验结论是___________________。
(4)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左至右原子的电子层数相同,随着核电荷数逐渐增多,原子半径逐渐_______,失电子能力逐渐_______,因此________逐渐减弱。