题目内容
【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
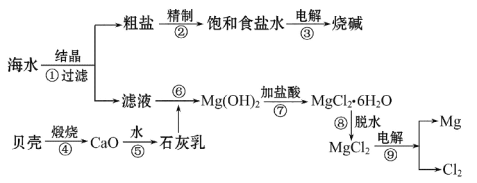
(1)上述流程图①~⑨步骤中,属于氧化还原反应的是__________(填序号);
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:(A.盐酸、B.Na2CO3溶液、C.NaOH溶液)。请你正确排列加入的顺序:__________(填编号);

(3)用如图电解饱和食盐水,石墨棒上产生的气体为Cl2;在铁棒周围的溶液里滴加紫色石蕊试液,溶液变成_____________色;
(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为__________(填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
【答案】③⑨ B、C、A或C、B、A 红色 BC
【解析】
(1)逐步分析个步骤的变化,判断答案;
(2)根据提供的试剂,可以选用Na2CO3溶液除去粗盐中仅含有Ca2+、再用NaOH溶液除去Mg2+,最后加入盐酸调节溶液的pH;
(3)根据图示,石墨电极为阳极,发生氧化反应,溶液中的氯离子放电生成氯气,铁为阴极,溶液中的氢离子放电生成氢气,铁棒周围的溶液的碱性增强,滴加酚酞,溶液变红色;
(4)因为氯化镁的溶解度随着温度的升高而增大,所以从氯化镁溶液中获取MgCl2·6H2O晶体,可以先将溶液加热蒸发水分,制成热的氯化镁饱和溶液,然后冷却结晶
。
(1)逐步分析个步骤的变化,判断答案:①蒸发、结晶、过滤属于物理变化;②粗盐精制是用Na2CO3和NaOH除去粗盐中的钙离子和镁离子,不发生氧化还原反应;③点解食盐水是氧化还原反应;④、⑤、⑥、⑦、⑧五个步骤是生产生石灰,熟石灰、沉淀镁离子,制取氯化镁,均不是氧化还原反应;⑨点解氯化镁制金属镁是氧化还原反应。故属于氧化还原反应的是:③⑨;
(2)根据提供的试剂,可以选用Na2CO3溶液除去粗盐中仅含有Ca2+、再用NaOH溶液除去Mg2+,最后加入盐酸调节溶液的pH,因此加入的顺序为B、C、A或C、B、A,故答案为:B、C、A或C、B、A;
(3)根据图示,石墨电极为阳极,发生氧化反应,溶液中的氯离子放电生成氯气,铁为阴极,溶液中的氢离子放电生成氢气,铁棒周围的溶液的碱性增强,滴加酚酞,溶液变红色,故答案为:红色;
(4)因为氯化镁的溶解度随着温度的升高而增大,所以从氯化镁溶液中获取MgCl2·6H2O晶体,可以先将溶液加热蒸发水分,制成热的氯化镁饱和溶液,然后冷却结晶,过滤即得MgCl2·6H2O晶体,正确答案是BC。

【题目】为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:
实验 步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中; 2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3将一小段镁带投入稀盐酸中; 4将一小片铝投入稀盐酸中. |
实验 现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
(1)请在下表中填写与实验步骤对应的实验现象序号:
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)请写出镁与水反应的化学方程式:_______________。
(3)实验结论是___________________。
(4)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左至右原子的电子层数相同,随着核电荷数逐渐增多,原子半径逐渐_______,失电子能力逐渐_______,因此________逐渐减弱。