题目内容
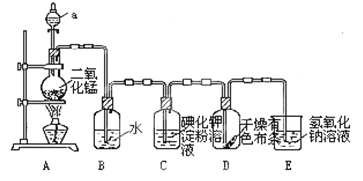
【题目】下图是一套制取并验证氯气部分化学性质的实验装置。
回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为___________。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式_______________________________________________
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为______色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
_______________________________________________________________。
(5)装置E的作用是___________。并写出该反应的化学方程式:________________。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ___________________。
【答案】浓盐酸 < Cl2+H2OHCl+HClO 蓝色 能,因为湿润的氯气有漂白性 吸收多余的氯气 Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,故分液漏斗中装的是浓盐酸;
(2)由于反应Cl2+H2OHCl+HClO生成了酸,故溶液呈酸性,pH<7;
(3)由于反应生成碘单质:Cl2+2I-=2Cl-+I2,使淀粉呈蓝色;
(4)由于氯气为湿润的,故有次氯酸生成,具有漂白性,干燥的有色布条能褪色;
(5)氯气有毒,一般用碱液吸收:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)用氯气与石灰乳制取漂白粉,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

 阅读快车系列答案
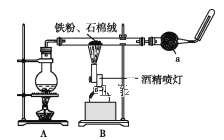
阅读快车系列答案【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。

(1)已知该实验反应的反应方程式为:__Fe+__H2O![]() __Fe3O4+__H2(请配平)。
__Fe3O4+__H2(请配平)。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用图中__(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448L,则铁粉的转化率为___。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②___ | Ⅲ.反应后的溶液中阳离子___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为___色 | ①___ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |