��Ŀ����
��14�֣��о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1����֪ʯī�ı�ȼ����Ϊy kJ��mol��1��1.2gʯī��1.68L����״����������ȼ�գ�����Ӧ��ľ����ų�x kJ��������ʯī��������Ӧ����CO���Ȼ�ѧ����ʽΪ ��
��2������ʱ����CO��ԭMgSO4���Ʊ��ߴ�MgO��
��750��ʱ����������к������ʵ���SO2��SO3����ʱ��Ӧ�Ļ�ѧ����ʽ�� ��
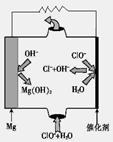
����MgO���Ƴɡ�þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ1���õ�ط�Ӧ�����ӷ���ʽΪ ��
 ��
�� 
ͼ1 ͼ2 ͼ3
��3��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g) CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
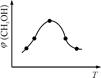
��ȡ��ݵ����CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ��������CO2ת��Ϊ�״���Ӧ�Ħ�H (�>�� ��<������)0��
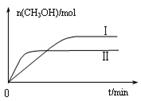
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ3��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>�� ��<������)��
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽͶ�뷴Ӧ�һ��ʱ���ﵽƽ�⡣
������ƽ��������ѹǿΪ��ʼʱ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ַ�Ӧ������У���c��ȡֵ��ΧΪ ��
��1����֪ʯī�ı�ȼ����Ϊy kJ��mol��1��1.2gʯī��1.68L����״����������ȼ�գ�����Ӧ��ľ����ų�x kJ��������ʯī��������Ӧ����CO���Ȼ�ѧ����ʽΪ ��
��2������ʱ����CO��ԭMgSO4���Ʊ��ߴ�MgO��
��750��ʱ����������к������ʵ���SO2��SO3����ʱ��Ӧ�Ļ�ѧ����ʽ�� ��
����MgO���Ƴɡ�þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ1���õ�ط�Ӧ�����ӷ���ʽΪ ��

 ��
�� 
ͼ1 ͼ2 ͼ3
��3��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡ��ݵ����CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ��������CO2ת��Ϊ�״���Ӧ�Ħ�H (�>�� ��<������)0��
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ3��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>�� ��<������)��
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽͶ�뷴Ӧ�һ��ʱ���ﵽƽ�⡣
| �� �� | �� | �� |
| ��Ӧ�� Ͷ���� | 1molCO2 3molH2 | a molCO2��b molH2�� c molCH3OH(g)��c molH2O(g) |
������ƽ��������ѹǿΪ��ʼʱ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ַ�Ӧ������У���c��ȡֵ��ΧΪ ��
��1��C(ʯī) +1/2O2(g) = CO(g) ��H 2=" -(20x-y)" kJ��mol��1��2�֣�
��2����2MgSO4 + CO ="====" 2MgO + SO2 + CO2 + SO3��2�֣���
��Mg + ClO- + H2O = Cl- + Mg(OH)2��2�֣���
��3����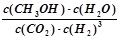 ��2�֣�
��2�֣�
�ڣ� ��2�֣�
��> ��2�֣�
��0.4�� c��1 ��2�֣�
��2����2MgSO4 + CO ="====" 2MgO + SO2 + CO2 + SO3��2�֣���
��Mg + ClO- + H2O = Cl- + Mg(OH)2��2�֣���
��3����
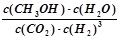 ��2�֣�
��2�֣� �ڣ� ��2�֣�
��> ��2�֣�
��0.4�� c��1 ��2�֣�
�����������1���÷�Ӧʽ����C��ʯī��+O2��g��=CO2��g������H��=��y kJ��mol��1����C(ʯī) +1/2O2(g) = CO(g)���˷�Ӧ̼�������������㣬����ֻ��Ӧ��1.68/22.4=0.075mol����1mol�ķ�Ӧ����Ӧ��Ϊx*��1.5/0.075��=20x;�ٸ��ݸ�˹��������H 2="-(20x-y)" kJ��mol��1�����մ�ΪC(ʯī) +1/2O2(g) = CO(g) ��H 2=" -(20x-y)" kJ��mol��1����2���ٸ��ݵ��ӵ�ʧ�غ㣬ȷ������þ������������������ļ���������д���̡�2MgSO4 + CO ="====" 2MgO + SO2 + CO2 + SO3�����ȿ��Դ�ͼ�п�����ʧ���ӵ����ӣ���ȷ���������ĵ缫����ʽ�����д�ܷ�Ӧʽ��Mg + ClO- + H2O = Cl- + Mg(OH)2����3���ٸ��ݹ�ʽ����д����
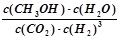 ������ͼ����֪����H<0���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ���Ӧ���ʺ��Ⱦ����������¶����ߵ�һ���̶ȣ���Ӧ�����ȷ�Ӧ���淴Ӧ���������Խ��Խ��ʹ�ü״������������(CH3OH)������С���۸���ͼ���֪��I�ļ״������ʵ�����ת���ʸߣ������ڼ���ʱ��ƽ�ⳣ���Ĺ�ʽ��
������ͼ����֪����H<0���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ���Ӧ���ʺ��Ⱦ����������¶����ߵ�һ���̶ȣ���Ӧ�����ȷ�Ӧ���淴Ӧ���������Խ��Խ��ʹ�ü״������������(CH3OH)������С���۸���ͼ���֪��I�ļ״������ʵ�����ת���ʸߣ������ڼ���ʱ��ƽ�ⳣ���Ĺ�ʽ��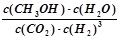 ��ƽ�ⳣ����С��ϵΪK��>K�����ܸ��ݻ�ѧƽ�ⷴӦ���м������£�
��ƽ�ⳣ����С��ϵΪK��>K�����ܸ��ݻ�ѧƽ�ⷴӦ���м������£�CO2(g) +3H2(g)
 CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)ʼ 1mol 3mol 0 mol 0 mol
�� x mol 3x mol x mol x mol
�� 1-x 3-3x x x
����ѹǿ��ԭ����0.8 ������[��1-x��+��3-3x��+x+x]/4=0.8���x=0.4mol,���ݵ�����ĵ�Чƽ�⣬�����ʵ�����ͬ�ſ��ԣ�����c�����ֵ��1mol,������ƽ��һ��ʼ���淽���ƶ�������c����0.4mol��
�����������ۺ��Ȼ�ѧ����ʽ����д����˹�����ͻ�ѧƽ��״̬���жϺͼ��㣬�����ѶȲ�����Ҳ��ʹ�ýϳ��������ʽ�ķ������ؼ�����ץס�����ʱ��Чƽ����Ҫ���ʵ�����ԭ��ϵ��ͬ�����߲ŵ�Ч��

��ϰ��ϵ�д�
�����Ŀ
 ���ڣ��Ҳ���Hԭ��ֱ��������ȼ�ϵ���������N2O4��ȼ�ղ���ֻ��CO2��H2O��N2��5.00g��ƫ�����¡���ȫȼ��ʱ�ɷų�212.5kJ������
���ڣ��Ҳ���Hԭ��ֱ��������ȼ�ϵ���������N2O4��ȼ�ղ���ֻ��CO2��H2O��N2��5.00g��ƫ�����¡���ȫȼ��ʱ�ɷų�212.5kJ������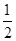 O2(g)===H2O(l)����H3����285.8 kJ/mol
O2(g)===H2O(l)����H3����285.8 kJ/mol
 ��
�� 
