题目内容
火箭的主要燃料是“偏二甲肼”,已知该化合物由C.H、N三种元素组成, WC=40%,WH=13.33%,其分子量为60。通过结构分析可知,该物质分子中其中有一个氮原子以  存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
(1)试推算“偏二甲肼”的分子式,并写出它的结构简式。
(2)写出燃料燃烧的热化学方程式。
 存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。(1)试推算“偏二甲肼”的分子式,并写出它的结构简式。
(2)写出燃料燃烧的热化学方程式。
(1) C2H8N2 ;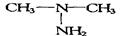
(2)C2H8N2(l)+2N2O4(l)=2CO2(g)+4H2O(g)+3N2(g) △H =-2250kJ/mol
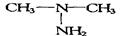
(2)C2H8N2(l)+2N2O4(l)=2CO2(g)+4H2O(g)+3N2(g) △H =-2250kJ/mol
试题分析:(1)根据题意可知,氮元素的质量分数是(100-40-13.33)%=46.7%,所以分子中碳原子的个数是
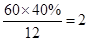 、氢原子的个数是
、氢原子的个数是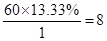 、氮原子的个数是
、氮原子的个数是 ,所以化学式是C2H8N2。又因为该物质分子中其中有一个氮原子以
,所以化学式是C2H8N2。又因为该物质分子中其中有一个氮原子以  存在,且不与H原子直接相连,据此可知其结构简式是
存在,且不与H原子直接相连,据此可知其结构简式是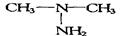 。
。(2)5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量,则1mol该化合物反应放出的热量是
 ,所以该反应的热化学方程式是C2H8N2(l)+2N2O4(l)=2CO2(g)+4H2O(g)+3N2(g) △H =-2250kJ/mol
,所以该反应的热化学方程式是C2H8N2(l)+2N2O4(l)=2CO2(g)+4H2O(g)+3N2(g) △H =-2250kJ/mol点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养与基础知识的巩固与训练,难度不大。有助于培养学生的逻辑推理能力和规范的答题能力,也有利于提高学生的应试能力和学习效率。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目

 4CO2(g) + 2H2O(l) + 2600 kJ
4CO2(g) + 2H2O(l) + 2600 kJ
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H