题目内容
16.维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定.该反应的化学方程式如下:C6H8O6+I2═C6H6O6+2HI现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
取10mL 6mol•L-1CH3COOH溶液,加入100mL蒸馏水,将溶液加热煮沸后冷却.精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL指示剂,立即用浓度为0.05000mol•L-1的I2溶液进行滴定到终点,消耗21.00mL I2溶液.
(1)实验中的指示剂是淀粉溶液.
(2)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用.煮沸的目的是除去溶液中溶解的O2;冷却的目的是避免维生素C被O2氧化.
(3)计算样品中维生素C的质量分数(要求列式,且式中各物理量带单位).
分析 (1)单质碘遇到淀粉变蓝色;
(2)加热煮沸可以除去溶液中溶解的气体;根据题中信息可知维生素C具有较强的还原性;
(3)计算滴定过程中消耗碘单质的物质的量,再根据方程式C6H8O6+I2→C6H6O6+2HI计算样品中维生素C的物质的量,进而计算质量分数.
解答 解:(1)单质碘遇到淀粉变蓝色,弱酸性溶液中用已知浓度的I2溶液进行滴定维生素C,可以用淀粉作指示剂;
故答案为:淀粉溶液;
(2)由于维生素C具有较强的还原性,易被氧气氧化,煮沸是为了除去溶液中溶液的O2,避免维生素C被O2氧化;
故答案为:除去溶液中溶解的O2;避免维生素C被O2氧化;
(3)滴定过程中消耗碘单质的物质的量=0.021 L×0.05mol/L,根据方程式C6H8O6+I2→C6H6O6+2HI可知,样品中维生素C的物质的量=n(I2)=0.021 L×0.05mol/L,
则样品中维生素C的质量分数=$\frac{0.021L×0.05mol/L×176g/mol}{0.2g}$×100%=92.4%,
答:样品中维生素C的质量分数为92.4%.
点评 本题滴定为载体考查根据方程式计算、物质含量的测定,题目难度中等,注意对题干信息的提取,侧重于考查学生分析能力和计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列关于硅的说法中,不正确的是( )
| A. | 硅是非金属元素,晶体硅是灰黑色有金属光泽的固体 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| D. | 二氧化硅常被用来制造光导纤维 |
7.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se.
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
4.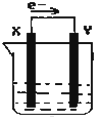 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )| A. | 外电路电流方向为:X→外电路→Y | |
| B. | 若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两极都是金属,则它们的活动顺序为X>Y |
8.已知某金属元素R的+1价阳离子最外层有2个电子,该阳离子有6个电子层下列推断正确的是( )
| A. | R元素位于第6周期,ⅢB族 | B. | R(OH)3与Al (OH)3一样是两性氢氧化物 | ||
| C. | R单质还原性比铝强 | D. | 离子半径:R3+>R+ |
5.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 乙烯能发生加成反应而乙烷不能 | |
| B. | 苯酚(C6H5OH)能跟NaOH溶液反应而乙醇不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
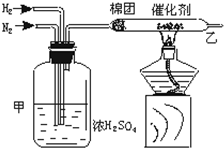 实验室中可用如图所示的装置合成NH3.
实验室中可用如图所示的装置合成NH3.