题目内容
以下有关原子半径的叙述正确的是( )
| A.原子半径的大小取决于原子核外电子层数 |
| B.原子半径的大小取决于核电荷数 |
| C.同周期主族元素,原子半径随原子序数增大而增大 |
| D.同主族元素,原子半径随原子序数减小而减小 |
A.原子半径大小由核电荷数、核外电子数、电子层数决定,故A错误;
B.原子半径大小由核电荷数、核外电子数、电子层数决定,故B错误;
C.同周期元素,原子电子层数相同,其原子半径随核电荷数的增加而减小,故C错误;
D.同主族元素,电子层越多原子半径越大,即原子半径随原子序数减小而减小,故D正确,
故选D.
B.原子半径大小由核电荷数、核外电子数、电子层数决定,故B错误;
C.同周期元素,原子电子层数相同,其原子半径随核电荷数的增加而减小,故C错误;
D.同主族元素,电子层越多原子半径越大,即原子半径随原子序数减小而减小,故D正确,
故选D.

练习册系列答案
相关题目
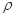 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,