题目内容
[化学——选修3:物质结构与性质](15分)
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大, 其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子,请回答下列问题:
(1)元素A、B、C的第一电离能由小到大的是_______(用元素符号表示)。
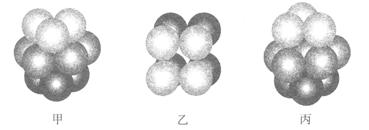
(2)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。
(3)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(4)任写一种与AB-离子互为等电子体的离子 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
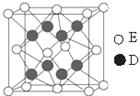
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,
已知晶体的密度为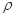 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,
则晶胞边长a= cm。(用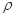 、NA的计算式表示)
、NA的计算式表示)
(7)A、B、C三种元素和氢元素形成的氰酸有两种结构,一种分子
内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,
且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写
出氰酸和异氰酸的结构式:_______________、______________。
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大, 其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子,请回答下列问题:
(1)元素A、B、C的第一电离能由小到大的是_______(用元素符号表示)。
(2)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。

(3)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(4)任写一种与AB-离子互为等电子体的离子 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,

已知晶体的密度为
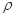 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm。(用
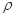 、NA的计算式表示)
、NA的计算式表示)(7)A、B、C三种元素和氢元素形成的氰酸有两种结构,一种分子
内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,
且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写
出氰酸和异氰酸的结构式:_______________、______________。
(1)C O N(1分)
(2)3d104s1 (1分) 丙(1分)
(3)平面三角形(1分),sp2(1分)
(4)C22- 或O22+(2分)
(5)Cu(OH)2+4NH3·H2O = Cu(NH3)42+ + 2OH- + 4H2O[或Cu(OH)2+4NH3 = Cu(NH3)42+ + 2OH-](2分)
(6)CaF2(2分) (2分)
(2分)
(7)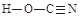 (1分)
(1分) (1分)
(1分)
(2)3d104s1 (1分) 丙(1分)
(3)平面三角形(1分),sp2(1分)
(4)C22- 或O22+(2分)
(5)Cu(OH)2+4NH3·H2O = Cu(NH3)42+ + 2OH- + 4H2O[或Cu(OH)2+4NH3 = Cu(NH3)42+ + 2OH-](2分)
(6)CaF2(2分)
 (2分)
(2分)(7)
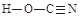 (1分)
(1分) (1分)
(1分)试题分析:首先确定A为碳元素,C为氧元素,根据“A、B、C”序数依次增大,确定B为氮元素,又根据“C与D形成的化合物中C显正化合价”可确定D为非金属性最强的氟元素,根据“E的M层电子数是N层电子数的4倍”确定E为钙元素,最后根据“F除最外层原子轨道处于半充满状态,其余能层均充满电子”确定F为铜元素。
⑴根据C、N、O的非金属性大小为C<N<O,则第一电离能大小为C<O<N(反常)。
⑵根据Cu原子的基态电子排布式为[Ar]3d104s1,则其外围电子的排布式为3d104s1;金属铜的堆积方式为面心立方最密堆积(丙图)。
⑶N与O形成的四原子阴离子为NO3-,中心原子的?键数=3,孤对电子对数=
 ,则中心原子的价电子对数为3,属于sp2杂化,由于无孤对电子,故其空间构型为平面三角形。
,则中心原子的价电子对数为3,属于sp2杂化,由于无孤对电子,故其空间构型为平面三角形。⑷根据“增减找邻、同族互换”原则可得CN-的等电子体离子有C22- 或O22+。
⑸Cu(OH)2溶于氨水生成Cu(NH3)4(OH)2(强电解质),据此可写出该反应的离子方程式。
⑹F与Ca形成的化合物为CaF2,在CaF2的晶胞中含有Ca:8×1/8+6×1/2=4(个),含F:8×1=8(个)则该晶胞的密度为
 ,化简得a=
,化简得a= cm。
cm。⑺根据由碳、氮、氧、氢元素构成的氰酸“分子内含有叁键,所有原子最外层均已达到稳定结构,分子中也不含环状结构”可确定其结构式为
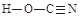 ;同理可确定异氰酸(分子内不含叁键)的结构式为
;同理可确定异氰酸(分子内不含叁键)的结构式为 。
。
练习册系列答案
相关题目
 键的数目为____ __________________.
键的数目为____ __________________. g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为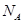 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含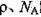 的计算式表示)
的计算式表示)



 ,下列叙述正确的有
,下列叙述正确的有  的熔点(填>、=或<),其原因是 。
的熔点(填>、=或<),其原因是 。