题目内容
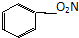
I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,X、Y在周期表中相对位置如图.
(1)X在周期表中的位置是______.
(2)Z单质与石灰乳反应的化学方程式为______.
(3)Y的气态氢化物通入FeCl3溶液中,有Y单质析出,该反应的离子方程式为______.
(4)W-Y高能电池是一种新型电池,它以熔融的W、Y单质为两极,两极之间通过固体电解质传递W+离子.电池反应为16W(l)+nY8(l)
8W2Yn(l).
放电时,W+离子向______极移动;正极的电极反应式为______.
Ⅱ.在容积可变的密闭容器中充入A、B、C三种气体,发生反应xA+yB?zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
(5)根据①②数据分析得出:x+y______z(填“>”、“<”或“=”).
(6)该温度下,当压强为1×106Pa时,此反应的平衡常数表达式为______.
(1)X在周期表中的位置是______.
(2)Z单质与石灰乳反应的化学方程式为______.
(3)Y的气态氢化物通入FeCl3溶液中,有Y单质析出,该反应的离子方程式为______.
(4)W-Y高能电池是一种新型电池,它以熔融的W、Y单质为两极,两极之间通过固体电解质传递W+离子.电池反应为16W(l)+nY8(l)
| 放电 |
| 充电 |
放电时,W+离子向______极移动;正极的电极反应式为______.
Ⅱ.在容积可变的密闭容器中充入A、B、C三种气体,发生反应xA+yB?zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
| 实验序号 | ① | ② | ③ |
| 压强∕pa | 1×105 | 2×105 | 1×106 |
| C(A)mol?l | 0.08 | 0.16 | 0.88 |
(6)该温度下,当压强为1×106Pa时,此反应的平衡常数表达式为______.

Ⅰ.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,由于最外层电子数不能超过8,又都是主族元素,故W最外层电子数只能为1,X的最外层电子数为4,由X、Y在周期表中相对位置可知,X为C元素、Y为S元素,结合原子顺序可知,W为Na、Z为Cl,
(1)X为C元素,在周期表中的位置是第二周期第ⅣA族,故答案为:第二周期第ⅣA族;
(2)氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)Y的气态氢化物H2S通入FeCl3溶液中,Fe3+离子氧化硫化氢生成单质S,自身为还有为Fe2+,同时生成H+,该反应的离子方程式为H2S+2Fe3+=S↓+2Fe2++2H+,
故答案为:H2S+2Fe3+=S↓+2Fe2++2H+;
(4)Na-S高能电池是一种新型电池,它以熔融的Na、硫单质为两极,两极之间通过固体电解质传递Na+离子,放电时,为原电池,Na+离子向正极移动,正极为S8获得电子得到Sn2-,正极电极反应式为:nS8+16e-=8Sn2-,
故答案为:正;nS8+16e-=8Sn2-;
Ⅱ.(5)根据①②数据可知,压强增大一倍,A的浓度增大一倍,说明增大压强平衡不移动,故x+y=z,故答案为:=;
(6)由②③数据可知,③的压强变为②的5倍,而A浓度变为②的5.5倍,说明增大压强平衡向逆反应方向移动,B物质发生液化,故xA(g)+yB?zC(g)的平衡常数k=
,故答案为:
.
(1)X为C元素,在周期表中的位置是第二周期第ⅣA族,故答案为:第二周期第ⅣA族;
(2)氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)Y的气态氢化物H2S通入FeCl3溶液中,Fe3+离子氧化硫化氢生成单质S,自身为还有为Fe2+,同时生成H+,该反应的离子方程式为H2S+2Fe3+=S↓+2Fe2++2H+,
故答案为:H2S+2Fe3+=S↓+2Fe2++2H+;
(4)Na-S高能电池是一种新型电池,它以熔融的Na、硫单质为两极,两极之间通过固体电解质传递Na+离子,放电时,为原电池,Na+离子向正极移动,正极为S8获得电子得到Sn2-,正极电极反应式为:nS8+16e-=8Sn2-,
故答案为:正;nS8+16e-=8Sn2-;
Ⅱ.(5)根据①②数据可知,压强增大一倍,A的浓度增大一倍,说明增大压强平衡不移动,故x+y=z,故答案为:=;
(6)由②③数据可知,③的压强变为②的5倍,而A浓度变为②的5.5倍,说明增大压强平衡向逆反应方向移动,B物质发生液化,故xA(g)+yB?zC(g)的平衡常数k=
| cz(C) |
| cx(A) |
| cz(C) |
| cx(A) |

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案
相关题目