题目内容
下列叙述不正确的是( )
| A.原子半径:H<Al<Mg<Na |
| B.热稳定性:HCl<H2S<PH3 |
| C.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强 |
| D.N、O、F元素非金属性依次增强 |
A、同周期从左到右原子半径逐渐减小,H的原子半径是所以元素中最小的,所以原子半径:H<Al<Mg<Na,故A正确;
B、非金属性越强,气态氢化物越稳定,非金属性Cl>S>P,则氢化物稳定性为HCl>H2S>PH3,故B错误;
C、非金属性越强,最高价氧化物对应的水化物酸性越强,非金属性Cl>S>P,则最高价氧化物对应的水化物酸性:H3PO4<H2SO4<HClO4,故C正确;
D、同周期从左到右元素非金属性逐渐增强,则N、O、F元素非金属性依次增强,故D正确;
故选B.
B、非金属性越强,气态氢化物越稳定,非金属性Cl>S>P,则氢化物稳定性为HCl>H2S>PH3,故B错误;
C、非金属性越强,最高价氧化物对应的水化物酸性越强,非金属性Cl>S>P,则最高价氧化物对应的水化物酸性:H3PO4<H2SO4<HClO4,故C正确;
D、同周期从左到右元素非金属性逐渐增强,则N、O、F元素非金属性依次增强,故D正确;
故选B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 键的数目为____ __________________.
键的数目为____ __________________. g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为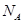 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含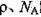 的计算式表示)
的计算式表示)
 ,下列叙述正确的有
,下列叙述正确的有  的熔点(填>、=或<),其原因是 。
的熔点(填>、=或<),其原因是 。