题目内容
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-==2CO32- |
| D.正极反应式为:2CO+2CO32-—4e-==4CO2 |
B
解析试题分析:A、该燃料电池中通入CO的一极是负极,负极上失电子发生氧化反应,错误;B、燃料电池中需要补充的是燃料和氧化剂,所以该电池工作过程中需不断补充CO和O2,而CO2可循环利用,正确;C、负极上的电极反应式为2CO-4e-+2CO32-=4CO2,错误;D、正极上的电极反应式为O2+4e-+2CO2=2CO32-,错误。
考点:本题考查原电池原理。

练习册系列答案
相关题目
下列叙述正确的是
| A.在原电池的正极和电解池的阳极上发生的都是氧化反应 |
| B.实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为2∶1 |
C.用铜作电极电解稀硫酸,可能发生反应:Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| D.在用惰性电极电解稀硫酸的过程中,溶液pH保持不变 |
Cu—Zn稀硫酸组成原电池装置,当导线中有0.5mol电子通过时,理论上两极的变化是
①锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
②铜极反应:2H++2e-=H2↑,锌片溶解16.25g
③电流由铜极经导线流向锌极 ④溶液中SO42-移向铜极
| A.①④ | B.③④ | C.②③ | D.①③ |
蓄电池在放电时起原电池作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时的反应: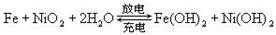
则下列有关对爱迪生蓄电池的推断错误的是
| A.放电时正极附近pH增大 |
B.充电时阴极的电极反应式为: 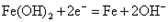 |
| C.放电时电解质溶液中的阴离子向正极方向移动 |
| D.蓄电池的电极可浸入某种碱性电解质溶液中 |
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是:( )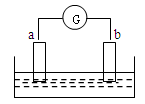
| A.a为负极,是铁片,烧杯中的溶液为硫酸 |
| B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C.a为正极,是碳棒,烧杯中的溶液为硫酸 |
| D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
