题目内容
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是:( )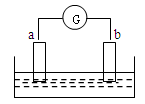
| A.a为负极,是铁片,烧杯中的溶液为硫酸 |
| B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C.a为正极,是碳棒,烧杯中的溶液为硫酸 |
| D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
C
解析试题分析:两电极一为碳棒,一为铁片,若电流表的指针发生偏转,则形成了原电池,由于活动性Fe>C,所以Fe为负极,C为正极,且a极上有大量气泡生成,溶液是酸性溶液,是硫酸。则b是Fe,是负极,在负极上发生反应:Fe-2e-=Fe2+;a是正极,正极材料是C。在正极上发生反应:2H++2e-=H2↑。故选项是C。
考点:考查原电池的构成条件、电极判断的知识。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
下列叙述是某同学做完铜锌原电池实验后得出的结论和认识,正确的是( )
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C.电流通过硫酸溶液,SO42- 向正极移动 |
| D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol 电子通过 |
关于下图的说法正确的是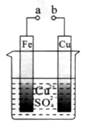
| A.构成原电池时Cu是负极 |
| B.构成电解池时Cu是阴极 |
| C.构成电解池时质量增重的极是阴极 |
D.电池工作时溶液中的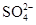 一定移向Cu极 一定移向Cu极 |
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-==2CO32- |
| D.正极反应式为:2CO+2CO32-—4e-==4CO2 |
如图所示,下列叙述中正确的是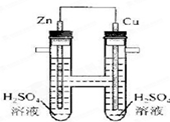
| A.正极发生氧化反应 | B.电子通过导线由铜流向锌 |
| C.负极有O2逸出 | D.铜上有H2逸出 |
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mol e- |
| C.随着反应的进行,正极附近的酸性减弱。 |
| D.电池正极的电极反应为4H++O2+4e-=2H2O |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是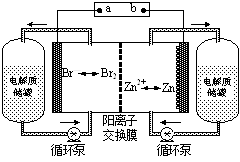
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
下列有关说法中不正确的是 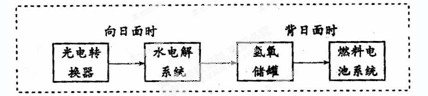
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |
| D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |