题目内容
(8分)可以将氧化还原反应2H2+O2=2H2O设计成原电池。
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_________________________
___________;负极的电极反应式为__________________________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为________________________
_____________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
(1)O2+4H++4eˉ=2H2O(2分);2H2-4eˉ=4H+(2分);
(2)CH4+10OH--8e-=CO32-+7H2O(2分);1(1分);10(1分);
解析试题分析:(1)酸性氢氧燃料电池中,负极上燃料失电子生成氢离子、正极上氧气得电子和氢离子反应生成水,正极反应为O2+4H++4eˉ=2H2O;负极反应为2H2-4eˉ=4H+。
(2)碱性甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成水和碳酸根离子,电极反应为CH4+10OH--8e-=CO32-+7H2O;电池反应式为CH4+2KOH+2O2=K2CO3+3H2O,根据KOH和转移电子之间的关系式得消耗n(KOH)=4mol÷8×2=1mol;甲烷取代反应中,被取代H原子的物质的量与氯气的物质的量相等,生成等物质的量的四种氯代物,则生成四种氯代物的物质的量都是1mol,消耗氯气的物质的量=1mol×(1+2+3+4)=10mol。
考点:本题考查原电池原理及物质的量的计算。

用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是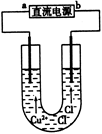
| A.a端是直流电源的负极 |
| B.通电使CuCl2发生电离 |
| C.阳极上发生的反应:Cu2++2e-=Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-==2CO32- |
| D.正极反应式为:2CO+2CO32-—4e-==4CO2 |
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mol e- |
| C.随着反应的进行,正极附近的酸性减弱。 |
| D.电池正极的电极反应为4H++O2+4e-=2H2O |
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)
构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:
4LiCl+S+SO2  4Li+2SOCl2。下列说法正确的是( )
4Li+2SOCl2。下列说法正确的是( )
| A.电池的电解液可为LiCl水溶液 |
| B.该电池放电时,负极发生还原反应 |
| C.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
| D.放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是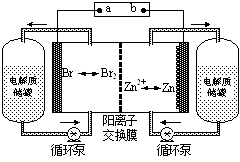
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是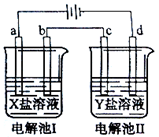
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |