题目内容
Cu—Zn稀硫酸组成原电池装置,当导线中有0.5mol电子通过时,理论上两极的变化是
①锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
②铜极反应:2H++2e-=H2↑,锌片溶解16.25g
③电流由铜极经导线流向锌极 ④溶液中SO42-移向铜极
| A.①④ | B.③④ | C.②③ | D.①③ |
C
解析试题分析:①锌极反应为:Zn-2e-=Zn2+,锌片上不生成H2,错误;②铜极为正极,发生反应:2H++2e-=H2↑,锌片溶解0.25mol,质量为16.25g,正确;③电流由原电池的正极经导线流向负极,所以由铜极经导线流向锌极,正确;④电解质溶液中,阴离子移向负极,所以溶液中SO42-移向锌极,错误,故C项正确。
考点:本题考查原电池原理。

用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 22.60 |
(1)图中甲为 滴定管,乙为 滴定管(填“酸式”或“碱式 ”);

(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用 做指示剂,滴定终点的判断依据是 ;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)该NaOH溶液的物质的量浓度为 mol/L (保留小数点后四位有效数字)。
用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是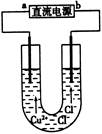
| A.a端是直流电源的负极 |
| B.通电使CuCl2发生电离 |
| C.阳极上发生的反应:Cu2++2e-=Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是
| A.H2O (l)+CaO(s) =Ca(OH)2(s) | B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O |
C.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ | D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) |
关于下图的说法正确的是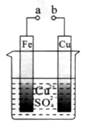
| A.构成原电池时Cu是负极 |
| B.构成电解池时Cu是阴极 |
| C.构成电解池时质量增重的极是阴极 |
D.电池工作时溶液中的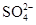 一定移向Cu极 一定移向Cu极 |
关于下图所示装置(盐桥含KCl)的叙述,正确的是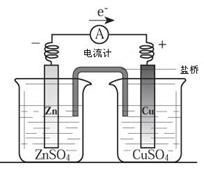
| A.铜离子在铜片表面被氧化 |
| B.铜作阳极,铜片上有气泡产生 |
| C.电流从锌片经导线流向铜片 |
| D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多 |
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-==2CO32- |
| D.正极反应式为:2CO+2CO32-—4e-==4CO2 |
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |