题目内容
下列装置或操作能达到实验目的的是
C
解析试题分析:A.乙醇与乙酸是相互溶解的,乙醇不能通过分液的方法分离提纯,错误;B.由于酒精是非电解质,所以不能共存原电池,错误;C.具有构成铝热反应的反应条件,正确;D.石油蒸馏时要垫上石棉网,而且要使用温度计,温度计的水银球在蒸馏烧瓶的支管口处,错误;
考点:考查化学实验操作与实验目的的关系的知识。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是
| A.H2O (l)+CaO(s) =Ca(OH)2(s) | B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O |
C.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ | D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) |
关于下图所示装置(盐桥含KCl)的叙述,正确的是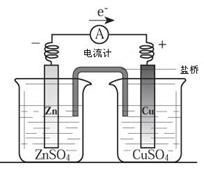
| A.铜离子在铜片表面被氧化 |
| B.铜作阳极,铜片上有气泡产生 |
| C.电流从锌片经导线流向铜片 |
| D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多 |
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-==2CO32- |
| D.正极反应式为:2CO+2CO32-—4e-==4CO2 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为


下列叙述不正确的是
A.充电时阳极反应为: |
B.放电时负极反应为: |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)
构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:
4LiCl+S+SO2 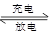 4Li+2SOCl2。下列说法正确的是( )
4Li+2SOCl2。下列说法正确的是( )
| A.电池的电解液可为LiCl水溶液 |
| B.该电池放电时,负极发生还原反应 |
| C.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
| D.放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
用铅蓄电池电解甲、乙电解池中的溶液。 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( ) 
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- = PbSO4 (s) +2H2O (l) |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |