题目内容
12.人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.配制KMnO4标准溶液
如图是配制50mLKMnO4标准溶液的过程图.
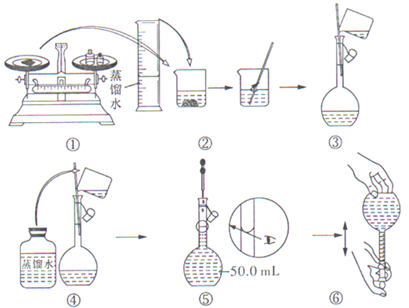
(1)请你观察图示判断,其中不正确的操作有②⑤(填序号,多选计0分);
(2)其中确定50mL溶液体积的容器是容量瓶 (填名称);
(3)如果用图示的操作配制溶液,在其他操作正确的情况下,所配制的溶液浓度将偏小(填偏大或偏小).
测定血液样品中Ca2+的浓度抽取血样20.00mI,经过上述处理后得到草酸,再用0.020mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mLKMnO4溶液.
(4)已知草酸跟KMnO4反应的离予方程式为:1MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则方程式中的x=2
(5)经过计算,血液样品中Ca2+的浓度为1.2mg/cm3.
分析 (1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)容量瓶是确定溶液体积的仪器;
(3)依据仰视刻度线,会使溶液体积偏大判断,结合C=$\frac{n}{V}$分析;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒和根据电荷守恒进行分析写出化学方程式得到x;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答 解:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,故答案为:②⑤;
(2)应该用容量瓶准确确定50mL溶液的体积,故答案为:容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,故答案为:偏小;
(4)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,
根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=2.5×2.4×10-4mol=6
10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:$\frac{0.024g}{20c{m}^{3}}$=1.2 mg/cm3,
故答案为:1.2.
点评 本题考查了配制一定物质的量浓度的方法及误差分析,题目难度不大,注意掌握配制一定浓度的溶液的方法及误差分析方法及技巧.

| A. | 硫酸铝溶液与过量Ba(OH)2溶液反应2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2A1O2-+4H2O | |
| B. | 碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+=CO2↑+H2O | |
| C. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+402↑ | |
| D. | 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO |
| 物质(杂质) | 除杂药品 | 离子方程式 |
| NaHCO3溶液(Na2CO3) | ||
| CO2(HCl) | ||
| FeCl2溶液(FeCl3) | ||
| FeCl3溶液(FeCl2) |
| A. | 氮氧化铝中氮的化合价是-1价 | |
| B. | 反应中氮气作氧化剂,碳做还原剂 | |
| C. | 反应中每生成5.7g AlON 同时生成1.12 L CO | |
| D. | 反应中氧化产物和还原产物的物质的量之比是1:2 |
 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等. 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol,
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol,