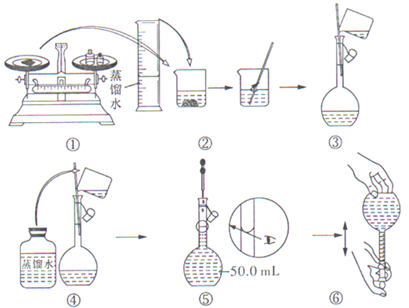
题目内容
2.在1L密闭容器中,把1mol A和1mol B混合发生如下反应:3A(g)+B(g)?xC(g)+2D(g),2分钟后反应达到平衡时,生成0.4molD,并测得C的平衡浓度为0.4mol/L,通过计算完成下列问题:(1)x的值为2
(2)这段时间内用B的浓度变化表示反应速率为0.1mol/(L.min)
(3)平衡时B的转化率为20%
(4)若在该平衡下,在保持体积不变时,向该容器内充入氦气,则该平衡向不移动(填“正向移动”“逆向移动”“不移动”)
(5)若在该平衡下,在保持容器体积不变时,再向容器中充入2mol A,达到新平衡时,A的转化率减小,B的转化率增大 (填“增大”“减小”“不变”)
(6)如果加入0.2mol的C、0.2mol D、0.9mol B和0.7mol A充入到原来容器内,保持原来的条件不变,则达到平衡时A的物质的量浓度是0.4mol/L.
分析 在1L密闭容器中,把1mol A和1mol B混合,2分钟后反应达到平衡时,生成0.4molD,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):1 1 0 0
变化量(mol):0.6 0.2 0.2x 0.4
平衡量(mol):0.4 0.8 0.2x 0.4
(1)根据平衡时C的浓度计算x;
(2)根据v=$\frac{△c}{△t}$计算v(B);
(3)平衡时B的转化率=$\frac{消耗B的物质的量}{B的起始物质的量}$×100%;
(4)若在该平衡下,在保持体积不变时,向该容器内充入氦气,反应混合物各组分浓度不变,平衡不移动;
(5)若在该平衡下,在保持容器体积不变时,再向容器中充入2mol A,平衡正向移动,A的转化率减小,B的转化率增大;
(6)根据(1)计算可知x=2,如果加入0.2molC、0.2mol D、0.9mol B和0.7mol A充入到原来容器内,等效为开始加入1mol B和1mol A,与原平衡为完全等效平衡,平衡时A的浓度相等.
解答 解:在1L密闭容器中,把1mol A和1mol B混合,2分钟后反应达到平衡时,生成0.4molD,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):1 1 0 0
变化量(mol):0.6 0.2 0.2x 0.4
平衡量(mol):0.4 0.8 0.2x 0.4
(1)C的平衡浓度为0.4mol/L,则1L×0.4mol/L=0.2x,解得x=2,故答案为:2;
(2)2min内,用B的浓度变化表示反应速率v(B)=$\frac{\frac{0.2mol}{1L}}{2min}$=0.1mol/(L.min),故答案为:0.1mol/(L.min);
(3)平衡时B的转化率=$\frac{0.2mol}{1mol}$×100%=20%,故答案为:20%;
(4)若在该平衡下,在保持体积不变时,向该容器内充入氦气,反应混合物各组分浓度不变,平衡不移动,故答案为:不移动;
(5)若在该平衡下,在保持容器体积不变时,再向容器中充入2mol A,平衡正向移动,A的转化率减小,B的转化率增大,故答案为:减小;增大;
(6)根据(1)计算可知x=2,如果加入0.2molC、0.2mol D、0.9mol B和0.7mol A充入到原来容器内,等效为开始加入1mol B和1mol A,与原平衡为完全等效平衡,平衡时A的浓度相等,即平衡时A的浓度为$\frac{0.4mol}{1L}$=0.4mol/L,故答案为:0.4mol/L.
点评 本题考查化学平衡计算与影响因素、反应速率计算等,(6)中注意利用等效平衡进行解答,也可以利用平衡常数计算,但相对比较繁琐.

| A. | ①②③ | B. | ③④ | C. | ②⑤⑥ | D. | ①②③④⑤⑥ |
| A. | $\frac{1}{{K}_{2}}$,2a | B. | $\frac{1}{K}$,a | C. | K2,a | D. | K,2a |
| A. | Y的单质能与X的最高价氧化物发生置换反应 | |
| B. | 同周期元素形成的简单离子中,Z离子的半径最小 | |
| C. | W的某含氧酸钠盐溶液是制备木材防火剂的原料 | |
| D. | R的单质在纯氧中燃烧生成其最高价氧化物 |
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0.则金刚石比石墨稳定 | |
| B. | 已知2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol.则该反应的中和热为114.6 kJ/mol | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ |
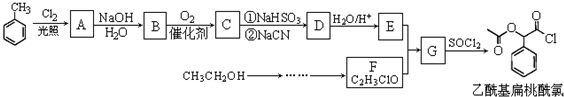

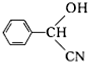 .
.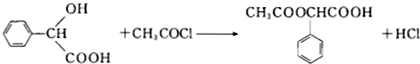 .
. .
.