题目内容
3.下列离子方程式正确的是( )| A. | 硫酸铝溶液与过量Ba(OH)2溶液反应2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2A1O2-+4H2O | |
| B. | 碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+=CO2↑+H2O | |
| C. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+402↑ | |
| D. | 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO |
分析 A.氢氧化钡过量,反应生成硫酸钡沉淀、偏铝酸钠和水;
B.碳酸钠溶液中滴加盐酸至恰好要出现气泡时,碳酸钠与盐酸反应生成碳酸氢钠;
C.2mol高锰酸根离子完全反应失去10mol电子,应该生成5mol氧气,该反应不满足电子守恒;
D.亚硫酸根离子被氯气氧化成硫酸根离子.
解答 解:A.硫酸铝溶液与过量Ba(OH)2溶液反应的离子方程式为:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2A1O2-+4H2O,故A正确;
B.碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止,碳酸根离子与氢离子反应生成碳酸氢根离子,正确的离子方程式为:CO32-+H+=HCO3-,故B错误;
C.酸性高锰酸钾溶液与H2O2溶液混合,发生氧化还原反应生成氧气,正确的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++6H2O+502↑,故C错误;
D.亚硫酸钠与氯气反应生成硫酸钠,正确的离子方程式为:SO32-+Cl2+H2O=2Cl-+2H++SO42-,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考高频题,题目难度中等,明确离子方程式的书写原则为解答关键,注意熟练掌握判断离子方程式正误的常用方法,如电荷守恒、电子守恒等,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列说法正确的是( )
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0.则金刚石比石墨稳定 | |
| B. | 已知2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol.则该反应的中和热为114.6 kJ/mol | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ |
8.在下列反应中,盐酸既表现酸的性质,又为还原剂的是( )
| A. | 4HCl+MnO2$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O | |
| B. | 2HCl+CaCO3=CaCl2+CO2+H2O | |
| C. | 2HCl+Zn=ZnCl2+H2↑ | |
| D. | HCl+AgNO3=AgCl↓+HNO3 |
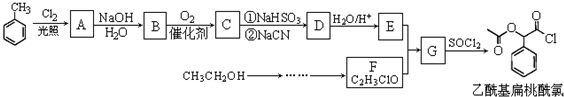

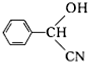 .
.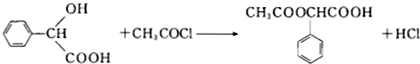 .
. .
.