题目内容
1. 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol,
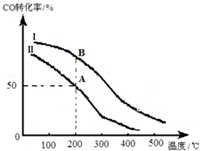
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol,为研究平衡时CO的转化率与反应物投料比($\frac{c(CO)起始}{c({H}_{2})起始}$)及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:
(1)反应热b<0 (填“>”或“<”).
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,
A点的平衡常数KA=1,
B点的平衡常数KB=KA(填“>”或“<”或“=”).
(3)为提高CO转化率可采取的措施是减小投料比、较低温度(答出两条即可).
分析 (1)分析图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向进行分析反应能量变化;
(2)结合投料比较少氢气物质的量,依据化学平衡三段式列式计算平衡浓度,得到A点的平衡常数,AB是相同温度下的平衡,平衡常数只随温度变化分析;
(3)为提高CO转化率,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行.
解答 解:(1)图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向,正反应为放热反应,b<0,
故答案为:<;
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,n(H2)=20mol,
CO(g)+2H2(g)═CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 1 0.5
A点的平衡常数KA =$\frac{0.5}{0.5×1{\;}^{\\;2}}$=1
AB是相同温度下的平衡,平衡常数只随温度变化,所以AB平衡常数相同;
故答案为:1;=;
(3)为提高CO转化率可采取的措施,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行,即减小投料比、较低温度、增大压强、分离出CH3OH;
故答案为:减小投料比、较低温度、增大压强、分离出CH3OH.
点评 本题考查了化学平衡、平衡常数,反应速率影响因素分析判断,化学平衡计算,化学平衡的建立过程分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
9.实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2-3cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为容量瓶不能受热,否则体积不准.
(4)若注入容量瓶前未恢复到室温,对所配溶液浓度将有何影响?偏高(填“偏低”“偏高”“无影响”)
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL | 应选用容量瓶的规格/mL |
| 2.1mL | 250mL |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2-3cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为容量瓶不能受热,否则体积不准.
(4)若注入容量瓶前未恢复到室温,对所配溶液浓度将有何影响?偏高(填“偏低”“偏高”“无影响”)
10.下列物质中,含氧原子最多的是( )
| A. | 标准状态时,22.4L的CO2 | B. | 200g49%的H3PO4 | ||
| C. | 32g 的SO2气体 | D. | 3.01×1023个O2分子 |