题目内容
12.下列说法正确的是( )| A. | CH3CH2 CH3的三个碳原子在一条直线 | |
| B. | CH2=CHCH3三个碳原子共平面 | |
| C. |  七个碳原子共平面 七个碳原子共平面 | |
| D. | CH4所有原子共平面 |
分析 A、直链烷烃碳原子呈锯齿状排列;
B、乙烯为平面结构,甲基取代一个H,甲基上的C与乙烯基共平面;
C、苯环为平面结构;
D、甲烷为正四面体结构.
解答 解:A、丙烷分子中三个碳原子呈锯齿形,不在同一直线上,故A错误;
B、乙烯为平面结构,甲基取代一个H,甲基上的C与乙烯基共平面,即三个碳原子在一条直线上,故B正确;
C、苯环为平面结构,苯环上的一个呗甲基取代,甲基上的C与苯环共平面,故C正确;
D、甲烷为正四面体结构,五个原子不可能共平面,故D错误,故选BC.
点评 本题主要考查的是常见有机化合物的结构,掌握甲烷、乙烯、乙炔与苯的结构是解决此类题的关键,难度不大,为常考题.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
2.为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动.该同学设计了如下方案,其中错误的是( )
| A. | 先配制0.10 mol/L CH3COOH溶液,再测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 先配制0.01 mol/L和0.10 mol/L的CH3COOH,再分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 | |
| C. | 取等体积、等pH的CH3COOH的溶液和盐酸分别与足量锌反应,测得反应过程中醋酸产生H2速率较慢且最终产生H2较多,则可证明醋酸为弱电解质 | |
| D. | 配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
3.下列说法正确的是( )
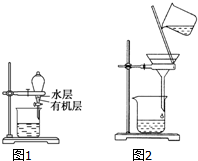

| A. | 分离乙醇和乙酸乙酯的混合物,所用玻璃仪器为分液漏斗、烧杯 | |
| B. | 用如图1所示装置分离CCl4萃取碘水后已分层的有机层和水层 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | 用如图2所示装置除去乙醇中的苯酚 |
20.食品香精菠萝酯的生产路线(反应条件略去)如图所示.下列叙述错误的是( )
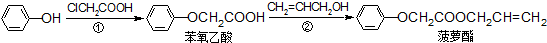
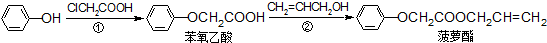
| A. | 步骤①产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 步骤②产物中残留的CH2=CHCH2OH可用溴水检验 | |
| C. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| D. | 苯氧乙酸和菠萝酯均可与H2在一定条件下发生反应 |
7.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成 CO2 | |
| B. | 所有的醇在铜做催化剂加热的条件下,都能与O2 发生氧化 | |
| C. | 甲烷和氯气在光照下的反应与苯的硝化反应的反应类型相同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键 |
17.下列有关叙述正确的是( )
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是因为元素原子最外层电子数由1→8周期性变化而引起的 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
4.二次电池又叫可逆电池,下列电池不属于二次电池的是( )
| A. | 酸性锌锰干电池和碱性锌锰干电池 | B. | 铅蓄电池 | ||
| C. | 氢气燃料电池和甲烷燃料电池 | D. | 镍镉电池和锂电池 |
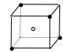 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A、D同主族,E和其它元素既不同期也不同主族,B、C、D最高价氧化物的水化物两两混合均能发生反应,A和E可组成离子化合物,其晶体结构示意图如图所示,其中“●”代表阳离子,“○”代表阴离子.
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A、D同主族,E和其它元素既不同期也不同主族,B、C、D最高价氧化物的水化物两两混合均能发生反应,A和E可组成离子化合物,其晶体结构示意图如图所示,其中“●”代表阳离子,“○”代表阴离子. H++F-.
H++F-.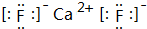 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.