题目内容
9.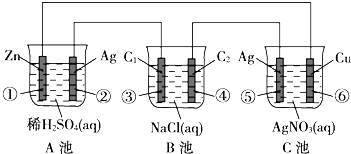 已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)
已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)(1)各装置名称是:A池原电池,B池电解池,C池电镀池(电解池).
(2)写出电极上发生的反应:②2H++2e-=H2↑,③2Cl--2e-=Cl2↑,⑥Ag++e-=Ag.
(3)当电路上有1mol电子流过时,①极上质量变化32.5g,⑤极上质量变化108g.
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是C池.
(5)A池中PH值将增大填(增大,不变,减小),B池中PH值将增大填(增大,不变,减小).
分析 (1)A是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B、C有外接电源,属于电解池;
(2)A原电池中,锌作负极,负极上锌失电子发生氧化反应,B是电解池,③作阳极,阳极上氯离子放电,⑤为阳极,发生氧化反应;
(3)①锌被氧化,⑥中铜电极上银离子得电子析出,根据锌、银和电子之间的关系式解答;
(4)电镀池的电解质溶液浓度不变;
(5)A消耗硫酸,pH增大,B电解食盐水生成氢氧化钠,pH增大.
解答 解:(1)A是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B有外接电源,属于电解池,C为电解池或电镀池,
故答案为:原电池;电解池;电镀池(电解池);
(2)②为原电池正极,发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,
③为电解池阳极,发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,
⑥为电解池阴极,发生还原反应生成Ag,电极方程式为Ag++e-=Ag,
故答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;Ag++e-=Ag;
(3)当电路上有1mol电子流过时,
①锌被氧化,电极反应式为:Zn-2e-=Zn2+,当电路上有1mol电子流过时,氧化锌的质量为0.5mol×65g/mol=32.5g,
⑤中银电极上银失电子,电极反应式为:Ag-e-=Ag+,当电路上有1mol电子流过时消耗银的质量=1mol×108g/mol=108g,
故答案为:32.5;108;
(4)C为电镀池,溶液浓度不变,故答案为:C池;
(5)A消耗硫酸,pH增大,B电解食盐水生成氢氧化钠,pH增大,故答案为:增大;增大.
点评 本题考查了原电池和电解池原理,难度不大,正确判断原电池和电解池是解本题关键,电极反应式的书写是学习难点.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 11.2g | B. | 5.6g | C. | 33.6g | D. | 22.4g |
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ①>②>④>③>⑤ | D. | ①>②>③>⑤>④ |
| A. | 验证淀粉水解产物时,在淀粉溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量的金属钠 | |
| C. | 向2mLl0%NaOH溶液中滴入2%CuS04溶液的4-6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有砖红色沉淀出现 | |
| D. | 植物油能使溴的四氯化碳溶液褪色,盛过油脂的试管用碱液洗涤 |
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨和1mol金刚石的总能量相等 |
 人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答:
人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答: 已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).
已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同). 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题: