题目内容
11.某CuCl2、FeCl3、HCl的混合液100ml,已知溶液中阳离子的浓度相同(不考虑水解),且Cl-的物质的量浓度为6mol/L,则此溶液最多溶解铁粉的质量为( )| A. | 11.2g | B. | 5.6g | C. | 33.6g | D. | 22.4g |
分析 根据Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeCl2,由氯离子的物质的量可知反应后溶液中Fe2+的物质的量,减去原溶液中Fe3+的物质的量,可计算最多溶解的铁粉的质量.
解答 解:n(Cl-)=0.1L×6mol•L-1=0.6mol,CuCl2、FeCl3、HCl的溶液中阳离子的浓度相同,则有n(Cu2+)=n(H+)=n(Fe3+),
由于溶液中阳离子的浓度相同,所以阳离子物质的量也相同,设Cu2+、Fe3+、H+三种离子物质的量均为n,
根据电荷守恒知道:2n+3n+n=0.6mol,解得:n=0.1mol,
Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeCl2,则n(FeCl2)=$\frac{1}{2}$×0.6mol=0.3mol,
根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为:0.3mol-0.1mol=0.2mol,
则此溶液最多溶解铁粉的质量为:0.2mol×56g/moL=11.2g,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、质量守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
19.使溴水褪色,发生取代反应的是( )
| A. | CH2=CH2 | B. | HC≡CH | C. | C2H5OH | D. | 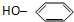 |
4.下列有机物属于芳香烃的是( )
①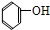 ②
②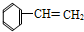 ③
③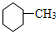 ④
④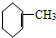 ⑤
⑤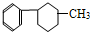 ⑥
⑥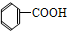 ⑦
⑦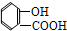 ⑧
⑧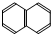 ⑨
⑨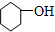 ⑩
⑩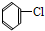
①
 ②
②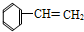 ③
③ ④
④ ⑤
⑤ ⑥
⑥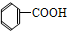 ⑦
⑦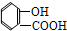 ⑧
⑧ ⑨
⑨ ⑩
⑩
| A. | ②③④⑤⑧⑩ | B. | ②⑤⑧ | C. | ③④⑧⑩ | D. | ②⑧⑩ |
11.下列各组内的物质属于同系物的是( )
| A. | CH3CH3 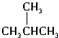 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH3 | |
| B. | CH3-CH3 CH2=CH-CH3 CH3CH=CHCH3 | |
| C. | 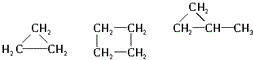 | |
| D. | CH3CH2CH2CH2CH3 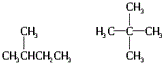 |
 ;
; A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+.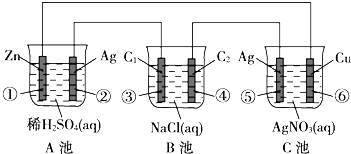 已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)
已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)