题目内容
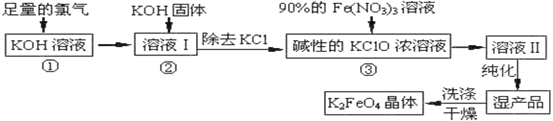
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。高铁酸钾为暗红色粉末状晶体,干燥的晶体80℃以下十分稳定,它极易溶于水,难溶于异丙醇。实验室模拟生产工艺流程如图:
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答的下列问题:
实验室可以利用如图装置完成流程①和②
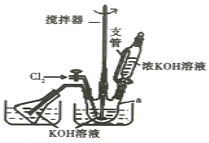
(1)恒压滴液漏斗支管的作用是_____,两水槽中的水为____(填“热水”或“冷水”)。
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是______;判断浓KOH溶液已过量的实验依据是___。
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为____。
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①粗产品用KOH溶解的目的是_____。
②如何判断K2FeO4晶体已经洗涤干净____。
【答案】平衡压强 冷水 过量的Cl2继续反应,生成更多的KClO 三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 增大氢氧根离子的浓度,抑制FeO42-的水解 用试管取少量最后一次的洗涤液,加入硝酸酸化的硝酸银溶液,若无白色沉淀则已被洗净
【解析】
足量Cl2通入和KOH溶液中,温度低时发生反应2KOH+Cl2=KCl+KClO+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4;
(1)恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,根据流程,需生成KClO,2KOH+Cl2=KCl+KClO+H2O(条件:较低温度),所以两水槽中的水为冷水;
故答案为:平衡压强;冷水;
(2)只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子,KOH和氯气反应生成KClO,所以加入KOH的目的是除去氯气且使溶液为后一步反应提供碱性,氯气为黄绿色气体,判断浓KOH溶液已过量的方法:三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾;
故答案为:与过量的Cl2继续反应,生成更多的KClO;三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾;
(3)据题目信息,反应物为:Fe3+、ClO-,生成物为:FeO42-、Cl-, Cl-,根据电子得失守恒:Fe(+3→+6),Cl(+1→-1),最小公倍数为6,所以Fe3+、FeO42-前系数都为2,ClO-、Cl-,前系数都为3,结合质量守恒和电荷守恒可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)①K2FeO4在水溶液中易水 4FeO42-+10H2O4Fe(OH)3(胶体)+8OH-+3O2↑,加入饱和KOH溶液可以增大氢氧根离子的浓度,使平衡向左移动,抑制FeO42-的水解;
故答案为:增大氢氧根离子的浓度,抑制FeO42-的水解;
②K2FeO4晶体表面若含有杂质离子为氯离子,所以只要检验最后一次的洗涤中无Cl-,即可证明晶体已经洗涤干净;
故答案为:用试管取少量最后一次的洗涤液,加入硝酸酸化的硝酸银溶液,若无白色沉淀则已被洗净;

 名校课堂系列答案
名校课堂系列答案