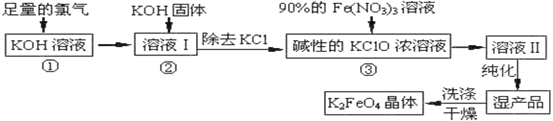
题目内容
【题目】某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量
请回答下列问题:
(1)该实验的目的是_________________
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是________________
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
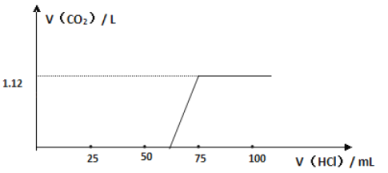
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?____________________________
【答案】测定NaOH的变质程度 61.3 烧杯玻璃棒量筒 8.00g 33.3% 50.0 NaOH被盐酸中和后继续滴加盐酸未立即产生气体 CO32-与盐酸的反应分步进行的
【解析】
(1)依据题干:计算出样品中变质NaOH的质量可知实验目的;
(2)已知20℃时,Na2CO3溶解度为21.7g,NaOH溶解度为108.3g,所以依据碳酸钠的溶解度计算需要水的质量;溶解固体需要的仪器:烧杯、玻璃杯、量筒;
(3)根据盐酸与碳酸钠反应的化学方程式和生成的二氧化碳的质量,列出比例式,就可计算出该样品中Na2CO3的质量,进而计算氢氧化钠的质量和变质程度;
(4)依据图象可知,NaOH被盐酸中和后继续滴加盐酸未立即产生气体,可知碳酸根离子与盐酸反应,先生成碳酸氢根离子,碳酸氢根离子再与盐酸反应生成二氧化碳,据此分析。
(1)依据题干可知,实验目的为:测定NaOH的变质程度;
(2)已知20℃时,Na2CO3溶解度为21.7g,NaOH溶解度为108.3g;若要将所称取的样品恰好溶解,设最多需要蒸馏水mg,则:21.7:100=13.3:m,解得m=61.3g;溶解固体需要的仪器:烧杯、玻璃杯、量筒;
(3)设该样品中Na2CO3的质量是x,
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 44
x 2.2g
∴106:44=x:2.2g,
解之得:x=5.3g,则NaOH的质量=13.3g-5.3g=8g;
则由碳酸钠的质量为5.3g,设反应的氢氧化钠的质量为z;
2NaOH+CO2═Na2CO3+H2O
80 106
z 5.3g
![]() =
=![]() ,解:z=4g,变质程度为:
,解:z=4g,变质程度为:![]() ×100%=33.3%;
×100%=33.3%;
氢氧化钠物质的量为:![]() =0.2mol,依据HCl~NaOH,可知消耗盐酸的物质的量为:0.2mol,与NaOH反应消耗的盐酸体积为:
=0.2mol,依据HCl~NaOH,可知消耗盐酸的物质的量为:0.2mol,与NaOH反应消耗的盐酸体积为:![]() =0.05L,即50mL;
=0.05L,即50mL;
(4)依据图象可知,NaOH被盐酸中和后继续滴加盐酸未立即产生气体,可知碳酸根离子与盐酸反应,先生成碳酸氢根离子,碳酸氢根离子再与盐酸反应生成二氧化碳,得出结论:碳酸根离子与盐酸的反应是分步进行的。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:
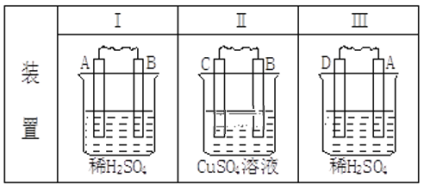
现象 | (I)金属A逐渐溶解 | (Ⅱ)C的质量增加 | (Ⅲ)A上有气体产生 |
填正极反应式 | ___ | ___ | |
四种金属活动性由强到弱的顺序:___。 | |||
若装置(Ⅲ)中A极产生的气体在标准状况下的体积为224mL,则通过导线中的电子的物质的量为___mol。 | |||