题目内容
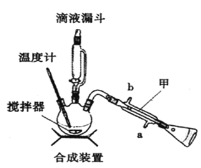
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
)可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,受热易分解,在酸性溶液中不能稳定存在.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
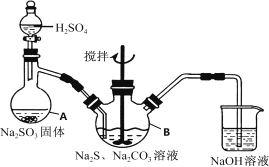
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的![]() 气体较均匀地通入
气体较均匀地通入![]() 和
和![]() 的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的![]() 接近7时,停止通入
接近7时,停止通入![]() 气体。
气体。
③趁热过滤,将滤液加热浓缩,冷却析出![]() 。
。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)仪器A的名称是_________。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液![]() ,请用离子方程式表示原因_________。
,请用离子方程式表示原因_________。
(3)写出三颈烧瓶B中制取![]() 反应的总化学反应方程式_________。
反应的总化学反应方程式_________。
(4)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:
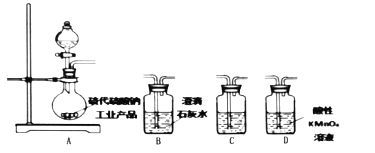
①实验装置的连接顺序依次_________(填装置的字母代号,各装置限用一次),装置C中的试剂为_________。
②能证明固体中含有碳酸钠的实验现象是_________。
③若要检验固体硫代硫酸钠工业产品中含有![]() ,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
,需先加水配成稀溶液,再依次加入的试剂为_________、_________和品红溶液。
(5)![]() 常用作脱氯剂,在溶液中易被
常用作脱氯剂,在溶液中易被![]() 氧化成
氧化成![]() ,该反应的离子方程式为_________。
,该反应的离子方程式为_________。
【答案】蒸馏烧瓶 ![]()
![]() ADCB 品红(或高锰酸钾) C中品红溶液不褪色(高锰酸钾不褪色),B中澄清石灰水变浑浊 氯化钡溶液(或氯化钙溶液) 盐酸
ADCB 品红(或高锰酸钾) C中品红溶液不褪色(高锰酸钾不褪色),B中澄清石灰水变浑浊 氯化钡溶液(或氯化钙溶液) 盐酸 ![]()
【解析】
该实验的目的是制取![]() ,(1)、(2)、(3)、(5)都属于基础题目,运用已学知识答题即可;(4)该实验目的是为了验证固体硫代硫酸钠工业产品中含有碳酸钠,而碳酸钠的检验方法是加酸,再用澄清石灰水检验生成的CO2,而硫代硫酸钠遇酸分解,产生的SO2会影响CO2的检验,故需要先出去SO2,以排除SO2的干扰。
,(1)、(2)、(3)、(5)都属于基础题目,运用已学知识答题即可;(4)该实验目的是为了验证固体硫代硫酸钠工业产品中含有碳酸钠,而碳酸钠的检验方法是加酸,再用澄清石灰水检验生成的CO2,而硫代硫酸钠遇酸分解,产生的SO2会影响CO2的检验,故需要先出去SO2,以排除SO2的干扰。
(1)仪器A是蒸馏烧瓶;
(2)题中告知Na2S2O3在酸性溶液中不稳定,是因为![]() ;
;
(3)制取Na2S2O3的总反应为![]() ;
;
(4)该实验目的是为了验证固体硫代硫酸钠工业产品中含有碳酸钠,而碳酸钠的检验方法是加酸,再用澄清石灰水检验生成的CO2,而硫代硫酸钠遇酸分解,产生的SO2会影响CO2的检验,故需要先出去SO2,以排除SO2的干扰,则:
①实验装置的连接顺序依次为ADCB;A为发生装置,烧瓶中的试剂为固体硫代硫酸钠工业产品,分液漏斗中的试剂为硫酸;D中KMnO4溶液是为了除去SO2,C中的试剂应为品红溶液或KMnO4溶液,用来验证SO2已被吸收完全,从而说明和D中澄清石灰水反应的全部是CO2;
②证明工业产品中有Na2CO3,需要确保和D中澄清石灰水反应的全部是CO2,则对应的现象为C中试剂不褪色,D中澄清石灰水变浑浊;
③实验室检验SO32-的方法为加酸,检验SO2,因此若要固体硫代硫酸钠工业产品中含有Na2SO3,需要将SO32-从工业产品中分离出来,再将SO32-转化为SO2,并检验SO2气体;故将固体硫代硫酸钠工业产品配成溶液后,依次需要加入的试剂为BaCl2(或CaCl2)溶液、稀盐酸和品红溶液;
(5)![]() 常用作脱氯剂,相关的离子方程式为
常用作脱氯剂,相关的离子方程式为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案