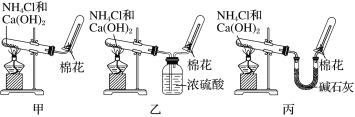
题目内容
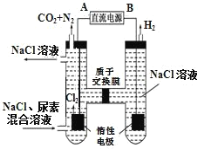
【题目】电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )
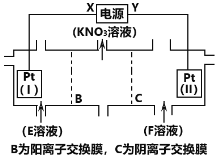
A.X为负极,F溶液为NaNO3溶液
B.电解一段时间,往Pt(I)附近滴入酚酞,溶液变红
C.电解的总反应为2H2O![]() 2H2↑ + O2↑
2H2↑ + O2↑
D.理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体
【答案】D
【解析】
电解KCl和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出口,结合B为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极上氯离子放电,阳极为氢离子放电,氯离子在阳极Pt片(I)上发生氧化反应失去电子生成氯气,氢离子在阴极Pt片(Ⅱ)上得到电子发生还原反应生成氢气,据此分析解答。
A.由上述分析可知E为氯化钾溶液,氯离子在阳极Pt片(I)发生氧化反应,Pt片(I)为阳极,则X为正极,故A错误;
B.氯离子在Pt片(I)发生氧化反应生成氯气逸出,水电离产生的氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,则Pt片(Ⅱ)附近氢氧根离子浓度大于氢离子浓度,显碱性,加入酚酞溶液显红色,故B错误;
C.阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,电解方程式为:H2O+2KCl![]() 2KOH+H2↑+Cl2↑,故C错误;
2KOH+H2↑+Cl2↑,故C错误;
D.当得到0.1molKNO3时,则有0.1mol钾离子透过阳离子交换膜,则转移0.1mol电子,阳极电极反应式:2Cl--2e-=Cl2↑,转移0.1mol电子生成0.05mol氯气,标况下体积为0.05mol×22.4L/mol=1.12L,故D正确;
故选D。

 愉快的寒假南京出版社系列答案
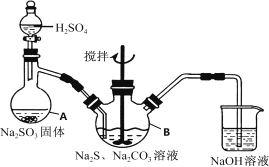
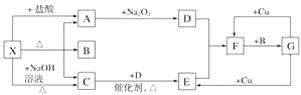
愉快的寒假南京出版社系列答案【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
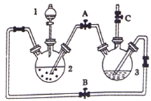
(1)稀硫酸应放在___(填写仪器名称)中。
(2)本实验通过关闭开关___、打开开关___,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___。
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为___。滴定终点的现象是___。
通过实验数据计算的该产品纯度为___(用字母a、b表示)。