题目内容
3.BN晶体,具有熔沸点高,耐磨擦和较高的硬度等性质.则BN的晶体类型是原子晶体,N的价层电子的电子排布图为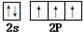 .
.
分析 原子晶体熔沸点较高,耐磨擦和较高的硬度;N原子核外有7个电子,分别位于1s、2s、2p轨道;
解答 解:原子晶体熔沸点较高,耐磨擦和较高的硬度,所以BN为原子晶体;N原子核外有7个电子,分别位于1s、2s、2p轨道,其价层电子的电子排布图为 ,故答案为:原子晶体;
,故答案为:原子晶体; .
.
点评 本题考查了晶体类型的判断以及原子核外价层电子的电子排布图的书写,明确原子结构及其原子晶体性质是解本题关键,难度不大.

练习册系列答案
相关题目
14.下列物质中既有配位键,又有离子键,还有共价键的是( )
| A. | NH4NO3 | B. | SiO2 | C. | 冰 | D. | O2 |
11.有关化学用语正确的( )
| A. | 乙烯的结构式:C2H4 | B. | 四氯化碳的电子式: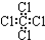 | ||
| C. | 甲烷分子的比例模型: | D. | 苯的分子式: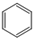 |
18.下列描述不正确的是( )
| A. | 碳原子核外电子有六种运动状态 | B. | NH4+ 中N原子轨道杂化类型为sp3 | ||
| C. | 电负性:O>Cl | D. | 第一电离能 Al>Mg |
8. 固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
 固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )| A. | 该电池的反应方程式为I2+2Ag═2AgI | |
| B. | 石墨电极为正极,银电极为负极 | |
| C. | 正极的电极反应是:Ag-e-═Ag+ | |
| D. | 装置中电子移动的途径是:银电极→导线→石墨电极 |
15.关于元素周期律和周期表,下列说法中正确的是( )
| A. | 在周期表中,主族元素的主族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强 | |
| C. | 同主族元素随着原子的核电荷数的递增,原子半径依次增大 | |
| D. | 主族元素的单质,随相对分子质量的增大,熔、沸点升高 |

 和
和 .甲烷和庚烷
.甲烷和庚烷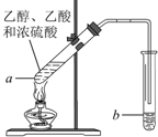 实验室制乙酸乙酯的主要装置如图所示,主要步骤为:
实验室制乙酸乙酯的主要装置如图所示,主要步骤为: