题目内容
10.下列说法中正确的是( )| A. | C60气化和I2升华克服的作用力相同 | |
| B. | 甲酸甲酯和乙酸的分子式相同,它们的熔点相近 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 用作高温结构陶瓷材料的固体是分子晶体 |
分析 A.C60和碘都为分子晶体;
B.乙酸含有氢键;
C.氯化氢为共价化合物;
D.用作高温结构陶瓷材料的固体为原子晶体.
解答 解:A.C60和碘都为分子晶体,C60气化和I2升华克服的作用力都为分子间作用力,故A正确;
B.乙酸含有氢键,沸点较高,故B错误;
C.氯化氢为共价化合物,不存在离子键,故C错误;
D.用作高温结构陶瓷材料的固体为原子晶体,如氮化硅等,故D错误.
故选A.
点评 本题考查较为综合,涉及化学键、晶体类型的判断,侧重双键的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关概念的理解和把握,难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
18.下列离子方程式或热化学方程式正确的是( )
| A. | 在不同温度下,以相同浓度相同体积的Na2S2O3与H2SO4反应来探究温度对化学反应速率的影响: 3S2O32-+2SO42-+10 H+═6SO2↑+2S↓+5 H2O | |
| B. | 已知25℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-2Q kJ•mol-1 | |
| C. | 表示中和热的热化学方程式:2HCl(aq)+Ba(OH)2(aq)═BaCl2(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| D. | 酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+=2I2+2H2O |
5.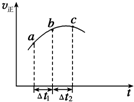 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )| A. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物浓度:a点小于b点 | |
| D. | 反应在C点达到平衡状态 |
19.使溴水褪色,发生取代反应的是( )
| A. | CH2=CH2 | B. | HC≡CH | C. | C2H5OH | D. | 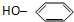 |
 ;
; ,F水溶液显性碱性(填:酸性、中性或碱性).
,F水溶液显性碱性(填:酸性、中性或碱性).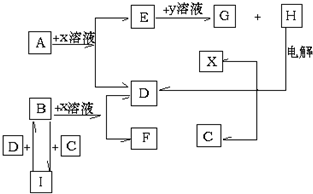
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+.