题目内容
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。
向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示[其中a点的坐标为(9.5,0.5)]。

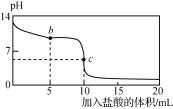
甲 乙
下列溶液中的关系中一定正确的是
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
【答案】B
【解析】
25℃时,根据图甲所示,可知CN-、HCN含量相等时,溶液呈碱性,说明HCN电离程度小于CN-水解程度,向10 mL 0.01 molL-1 NaCN溶液中逐滴加入0.01 molL-1的盐酸,其pH变化曲线如图乙所示,当加入盐酸5mL时,溶液组成为NaCN、HCN和NaCl,溶液呈碱性,加入盐酸10mL时,完全反应生成HCN和NaCl,溶液呈酸性,据此分析解答。
A.根据图甲,CN-、HCN含量相等时溶液的pH=9.5,图甲中可以加入HCN,调节溶液的pH=7,溶液中不一定存在c(Cl-),即不一定存在c(Cl-)=c(HCN),故A不选;
B.根据图甲,CN-、HCN含量相等时溶液的pH=9.5,HCN的电离平衡常数K(HCN)=![]() = c(H+)=10-9.5mol/L,则NaCN的水解平衡常数Kh(NaCN)=
= c(H+)=10-9.5mol/L,则NaCN的水解平衡常数Kh(NaCN)=![]() =
=![]() = 10-4.5mol/L,故B选;
= 10-4.5mol/L,故B选;
C.b点加入5mL盐酸,反应生成等浓度的NaCl、HCN,溶液组成为等物质的量浓度的NaCN、HCN和NaCl,根据图甲,CN-、HCN含量相等时溶液的pH=9.5,溶液呈碱性,则HCN电离程度小于CN-水解程度,可知c(HCN)>c(CN-),故C不选;
D.c点加入10mL盐酸,反应后得到等浓度的NaCl、HCN的混合液,任何电解质溶液中都存在电荷守恒和物料守恒,根据物料守恒得c(Cl-)=c(HCN)+c(CN-),而根据电荷守恒可知,c(Na+)+c(H+) = c(Cl-)+c(OH-)+c(CN-),则c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),故D不选;
答案选B。










