题目内容
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:3SiCl4 +2N2 +6H2![]() Si3N4 +12HCl。
Si3N4 +12HCl。
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于_____________晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是______________(填写元素符号);属于非极性分子的化合物的电子式是__________。
(2)比较Si和Cl两种元素非金属性强弱的方法是__________。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为_________________(简述理由),写出Si与强碱溶液反应的离子反应方程式:____________________________。
【答案】 原子 H、Cl 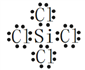 b 处在金属与非金属的分界线上 Si+2OH-+H2O=SiO32-+2H2↑
b 处在金属与非金属的分界线上 Si+2OH-+H2O=SiO32-+2H2↑
【解析】(1)氮化硅是一种新型的无机非金属材料,耐高温,属于原子晶体;H、N、Si、Cl四种原子的最外层电子构型分别为1s1、2s22p3、3s23p2、3s23p5,最外层未成对电子数分别为1、3、2、1,所以原子最外层只有一个未成对电子的元素是H和Cl;SiCl4为非极性分子,其电子式为: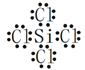 。
。
(2)气态氢化物沸点的大小与分子间作用力及氢键有关,与非金属性无关,a错误;原子获得一个电子时释放的能量越大,元素的非金属性越大,b正确;最高价氧化物的水化物的酸性越强,元素的非金属性越大,而不是指氢化物的酸性,c错误,故可以比较Si和Cl两种元素非金属性强弱的方法是答案b。
(3)Si、 Al、Be三种元素均处于金属与非金属元素的交界处,所以三者的化学性质相似;
Si与强碱溶液反应的离子反应方程式为:Si+2OH-+H2O=SiO32-+2H2↑。

【题目】Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(moll) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是___________(填字母);
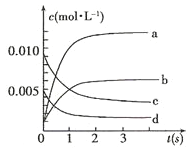
(2)800℃,反应达到平衡时,NO的转化率是___________;
(3)用O2表示从0~2s内该反应的平均速率v=___________。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________(填选项);
A.2v生(NH3)=v耗(CO2) B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变 D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___________(填选项);
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
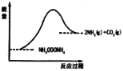
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。