题目内容
【题目】Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(moll) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
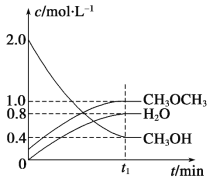
(1)下图中表示NO2的变化的曲线是___________(填字母);
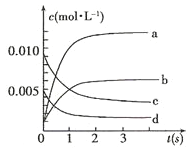
(2)800℃,反应达到平衡时,NO的转化率是___________;
(3)用O2表示从0~2s内该反应的平均速率v=___________。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________(填选项);
A.2v生(NH3)=v耗(CO2) B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变 D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___________(填选项);
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
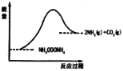
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。
【答案】b65%1.5×10-3mol/(L·s)ACBD大于
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,此反应在3s后一氧化碳的物质的量保持不变,证明到达化学反应平衡态。解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
Ⅰ(1) 根据表格知,随着反应的进行,一氧化氮的物质的量减小,则反应向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)= 0.013mol /2L=0.0065mol/L,可以知道表示NO2的变化的曲线是b;(2)由表格数据可以知道,3s时达到平衡,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,达到平衡时NO的转化率0.013/0.02×100%=65%; (3) 0~2s时,反应没有达到平衡,v(NO)=(0.020-0.008)mol/(2L×2s)=0.003mol/(L·s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=1/2 v(NO)=0.0015 mol/(L·s);
Ⅱ(1) A、只有表明是正反应速率还是逆反应速率时,才可以用来判断反应是否达到平衡, v生(NH3)=2v耗(CO2),错误;B、该反应是气体总物质的量增大的反应,当气体总物质的量不变时可以说明反应达到了平衡,正确;C、不管反应是否达到平衡,容器中CO2与NH3的物质的量之比均为1:2,错误;D、该反应是气体质量增大的反应,气体体积不变,当气体压强不变时,反应处于平衡状态,正确;E、形成6个N-H键即生成2个NH3,有2个C=O键断裂即消耗1个CO2,正反应速率等于负反应速率,可判定为平衡态,正确。故选AC。(2)改变反应速率的方法改变反应物浓度(除纯液体和纯固体外),增加温度,添加催化剂等,故选BD;(3)由图可知,反应物的总能量小于生成物的总能量,该反应为吸热反应,对于吸热反应来说反应物中化学键吸收的能量大于形成生成物中化学键放出的能量。

【题目】元素A~D是元素周期表中短周期的四种元素,根据表中信息回答下列问题。
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远。且其单质燃烧后生成淡黄色固体 |
B | 单质非常稳定,是空气的主要成分之一。其原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是黄绿色气体,原子的M层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表四种元素名称分别为:A____,B____,C____,D____。
(2)A、B、C、D原子半径由大到小的顺序为___。(用元素符号填写)
(3)写出B的气态氢化物与其最高价氧化物对应的水化物反应的离子方程式____。
(4)用电子式表示AC的形成过程____。
(5)C元素的单质的氧化性比溴单质的氧化性____(填“强”或“弱”),请设计实验证明___。(写实验操作和现象)