题目内容
15.设NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 常温常压下,22.4 L NO2中含有NA个分子 | |
| B. | 1 mol羟基中电子数为10 NA | |
| C. | R2+的质量数为A,中子数为N,则n g R该价态的氧化物中含质子数为$\frac{n}{A+16}$(A-N+8)NA | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
分析 A.常温常用Vm≠22.4L/mol;
B.1个羟基中含有9个电子;
C.质量数=质子数+中子数,依据n=$\frac{m}{M}$计算物质的量,结合氧化物中质子数计算;
D.在反应KIO3+6HI═KI+3I2+3H2O中,反应中元素化合价变化计算电子转移;
解答 解:A.常温常用Vm≠22.4L/mol,无法计算二氧化氮的分子数,故A错误;
B.1个羟基中含有9个电子,1 mol羟基中电子数为9 NA,故B错误;
C.质量数=质子数+中子数,质量数等于相对原子质量的近似整数值,依据n=$\frac{m}{M}$计算物质的量,结合氧化物中质子数计算所含质子数=$\frac{ng}{(A+16)g/mol}$(A-N+8)NA,故C正确;
D.在反应KIO3+6HI═KI+3I2+3H2O中,碘元素化合价+5价和-1价变化为0价,电子转移5mol,生成3mol碘单质,每生成3mol I2转移的电子数为5NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,熟悉有关物质的量的计算公式是解题关键,注意气体摩尔体积使用条件,注意羟基的结构,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
5.下列关于元素周期表和元素周期律的说法正确的是( )
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少 | |
| B. | 因为K比Na容易失去电子,所以K比Na的还原性强 | |
| C. | 第二周期元素从Li到F,非金属性逐渐减弱 | |
| D. | O与S为同主族元素,且O比S的非金属性弱 |
10.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1.0 mol•Lˉ1的醋酸溶液中CH3COOH和CH3COOˉ的总数为NA | |
| B. | 常温常压下,32g臭氧所含的氧原子数为2NA | |
| C. | 0.1mol Cu与足量浓硫酸反应生成SO2的体积约为2.24L | |
| D. | 2gCaCO3和8gKHCO3组成的混合物中碳原子数为0.1NA |
7.为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法都正确的是( )
| 选项 | 物质 | 除杂试剂 | 分离方法或操作 |
| A | 乙醇(水) | 无水CuSO4 | 充分反应后蒸馏 |
| B | 苯(Br2) | NaOH溶液 | 振荡静置后过滤 |
| C | NaCl固体(KNO3) | 水 | 高温溶解、降温结晶 |
| D | BaCO3(BaSO4) | 饱和Na2CO3溶液 | 充分浸泡后过滤 |
| A. | A | B. | B | C. | C | D. | D |
4.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列叙述正确的是( )
| A. | 价电子排布为4s24p2的元素位于第四周期第ⅤA族,是P区元素 | |
| B. | 1,2-二甲苯核磁共振氢谱中有三组峰,且氢原子数之比为3:1:1 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 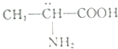 分子属于手性分子 分子属于手性分子 |
 烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.