题目内容
20.SO2是重要的大气污染物,工业生产中产生的含SO2烟气必须脱硫后才能排放,脱去烟气中SO2的方法有多种,回答下列问题:(1)“热解气还原法”:CO还原SO2生成S4和CO2,反应的化学方程式为8CO+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$S4+8CO2.
(2)“湿式吸收法”:利用吸收剂与SO2发生反应从而脱硫.
①下列试剂中适合用作该法吸收剂的是c(填字母,下同).
a.澄清石灰水 b.浓硫酸 C.Na2CO3溶液
②“钠碱法”用NaOH溶液作吸收剂,向100mL0.2mol•L-1NaOH溶液中通入标准状况下0.448LSO2气体,反应后测得溶液pH<7,则溶液中下列各离子浓度关系正确的是ab.
a.c(HSO3->c(SO32-)>c(H2SO3)
b.c(OH-)+c(SO32-)=c(H+)+c(H2SO3)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
③工业上常用Na2SO3溶液吸收烟气中的SO2,将烟气通入1.0mol•L-1的Na2SO3溶液,溶液pH不断减小(设这个过程中溶液体积不变),当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-)=0.2mol•L-1,则溶液中c(HSO3-)=1.6mol/L.
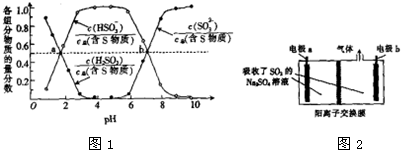
④“亚硫酸铵吸收法”用(NH4)2SO3溶液在吸收塔中封闭循环脱硫,发生的主要反应为(NH4)2SO3+SO2+H2O═2NH4HSO3,测得25℃时溶液pH与各组分物质的量分数的变化关系如图1所示,a点时n(HSO3-):n(H2SO3)=1:1,b点时溶液pH=7,则n(NH4+):n(HSO3-)=3:1.
(3)“离子膜电解法”利用硫酸钠溶液吸收SO2,再用惰性电极电解,将阴极区溶液导出,经过滤分离硫磺后,可循环吸收利用,装置如图2所示,则阴极的电极反应式为SO2+4H++4e-═S+2H2O,阳极产生气体的化学式为O2.
分析 (1)依据原子个数守恒、得失电子守恒书写方程式;
(2)①根据脱硫的原理,适合用作该法吸收剂的是能与SO2发生反应的物质;
②n(SO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,n(NaOH)=0.1L×0.2mol/L=0.02mol,二者反应的化学方程式为:SO2+NaOH=NaHSO3,反应后测得溶液pH<7,NaHSO3溶液呈酸性,说明HSO3-电离程度大于水解程度,结合溶液的电中性原则、物料守恒以及质子守恒解答该题;
③结合Na2SO3+SO2+H2O═2NaHSO3分析离子浓度,溶液pH约为6时,吸收SO2的能力显著下降,溶质为NaHSO3,则电离大于其水解;
④根据图象曲线在二者比值的变化及亚硫酸铵、亚硫酸氢铵的化学式组成进行分析、计算;
(3)电解池中阳极发生氧化反应,氢氧根离子失去电子生成氧气;阴极发生还原反应,二氧化硫在酸性环境下得到电子生成硫单质,据此解答.
解答 解:(1)由题意知:“热解气还原法”:CO还原SO2生成S4和CO2,依据原子个数守恒和得失电子守恒该反应的化学方程式:8CO+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$S4+8CO2;
故答案为:8CO+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$S4+8CO2;
(2)①a.澄清石灰水中氢氧根离子浓度较低,不适合做吸收剂,故a不选;
b.浓硫酸与二氧化硫不反应,不能吸收二氧化硫,故b不选;
C.亚硫酸的酸性强于碳酸,所以二氧化硫能与Na2CO3溶液反应,SO2+Na2CO3=Na2SO3+CO2,能够做吸收剂,故c选;
故选:c;
②(SO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,n(NaOH)=0.1L×0.2mol/L=0.02mol,二者反应的化学方程式为:SO2+NaOH=NaHSO3,
a.亚硫酸是弱酸,反应后测得溶液pH<7,NaHSO3溶液呈酸性,说明HSO3-电离程度大于水解程度,即c(SO32-)>c(H2SO3),NaHSO3溶液是盐溶液,电离出钠离子和亚硫酸氢根离子,HSO3-电离和水解程度相对于亚硫酸钠的电离都比较小,所以c(HSO3-)>c(SO32-)>c(H2SO3),故a正确;
b.根据亚硫酸氢钠溶液中的质子守恒可得:c(OH-)+c(SO32-)=c(H+)+c(H2SO3),故b正确;
c.溶液中一定存在电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数即:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故c错误;
故选:ab;
③由Na2SO3+SO2+H2O═2NaHSO3,c(SO32-)的浓度是0.2mol•L-1,依据原子个数守恒则反应的Na2SO3溶液为1.0mol/L-0.2mol/L=0.8mol/L,由反应中的物质的量关系可知,生成的c(HSO3-)为:0.8mol/L×2=1.6mol/L,
故答案为:1.6mol/L;
④“亚硫酸铵吸收法”用(NH4)2SO3溶液在吸收塔中封闭循环脱轨,发生的主要反应为(NH4)2SO3+SO2+H2O=2NH4HSO3,测得25℃时溶液pH与各组分物质的量分数的变化关系如图1所示,根据图象可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1;
b点时溶液pH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2n(SO32-),又根据图象曲线可知,n(HSO3-)=n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1,
故答案为:1:1;3:1;
(3)电解池中阳极发生氧化反应,氢氧根离子失去电子生成氧气;阴极发生还原反应,二氧化硫在酸性环境下得到电子生成硫单质,电极反应式为:SO2+4H++4e-═S+2H2O;
故答案为:SO2+4H++4e-═S+2H2O;O2.
点评 本题为综合题,设计二氧化硫的性质、有关方程式计算、离子浓度大小比较、电解池,熟悉相关知识是解题关键,注意溶液中三大守恒定律的应用,题目难度中等.

| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 热稳定性:H2S>H2O>HF | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:F2>Cl2>Br2 |
| A. | 常温常压下,22.4 L NO2中含有NA个分子 | |
| B. | 1 mol羟基中电子数为10 NA | |
| C. | R2+的质量数为A,中子数为N,则n g R该价态的氧化物中含质子数为$\frac{n}{A+16}$(A-N+8)NA | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
| A. | 元素Z、W分别与Y形成的常见化合物均为碱性氧化物 | |
| B. | X和R形成的常见化合物中各原子都达到8电子稳定结构 | |
| C. | 离子半径的大小顺序为:Z+>W2+>Y2- | |
| D. | 含有Y、Z、R三种元素的化合物最多只有3种 |
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 测定氨水的浓度 | 锥形瓶、滴定管、烧杯 | 氨水、1mol/L盐酸、甲基橙 |
| B | 制备Fe(OH)3胶体 | 烧杯、胶头滴管、酒精灯 | 饱和FeCl3溶液、NaOH溶液 |
| C | 检验丙烯醛中的碳碳双键 | 试管、胶头滴管 | 丙烯醛、溴水 |
| D | 配制100mL1mol/L硫酸 | 容量瓶、胶头滴管、10mL量筒、烧杯 | 18mol/L硫酸、蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 质子数为80 | B. | 中子数为46 | C. | 电子数为114 | D. | 质量数为34 |
| A. | CH4O和C2H6O | B. | C2H4和C6H12 | C. | C2H2和C4H6 | D. | CH4和C3H8 |

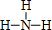 .
.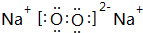 ,
,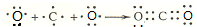 .
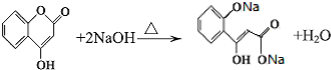
.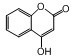 是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
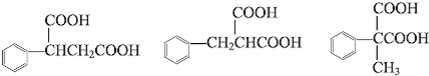 中的任意一种.
中的任意一种.